Amazonien, die Fische und der Sauerstoff …
Amazonien, die Fische und der Sauerstoff
Im Artikel „Amazonien, die Fische und der Sauerstoff“ (Hetz, 2006) ging ich in der DATZ auf die vielfältigen Möglichkeiten ein, die amazonische Fische entwickelt haben, um den Problemen der Sauerstoffversorgung zu begegnen und trotzdem Biotope erfolgreich besiedeln zu können. Hier ist mein damaliger Text etwas verändert bzw. um einige Aspekte ergänzt wiedergegeben.
Amazonien
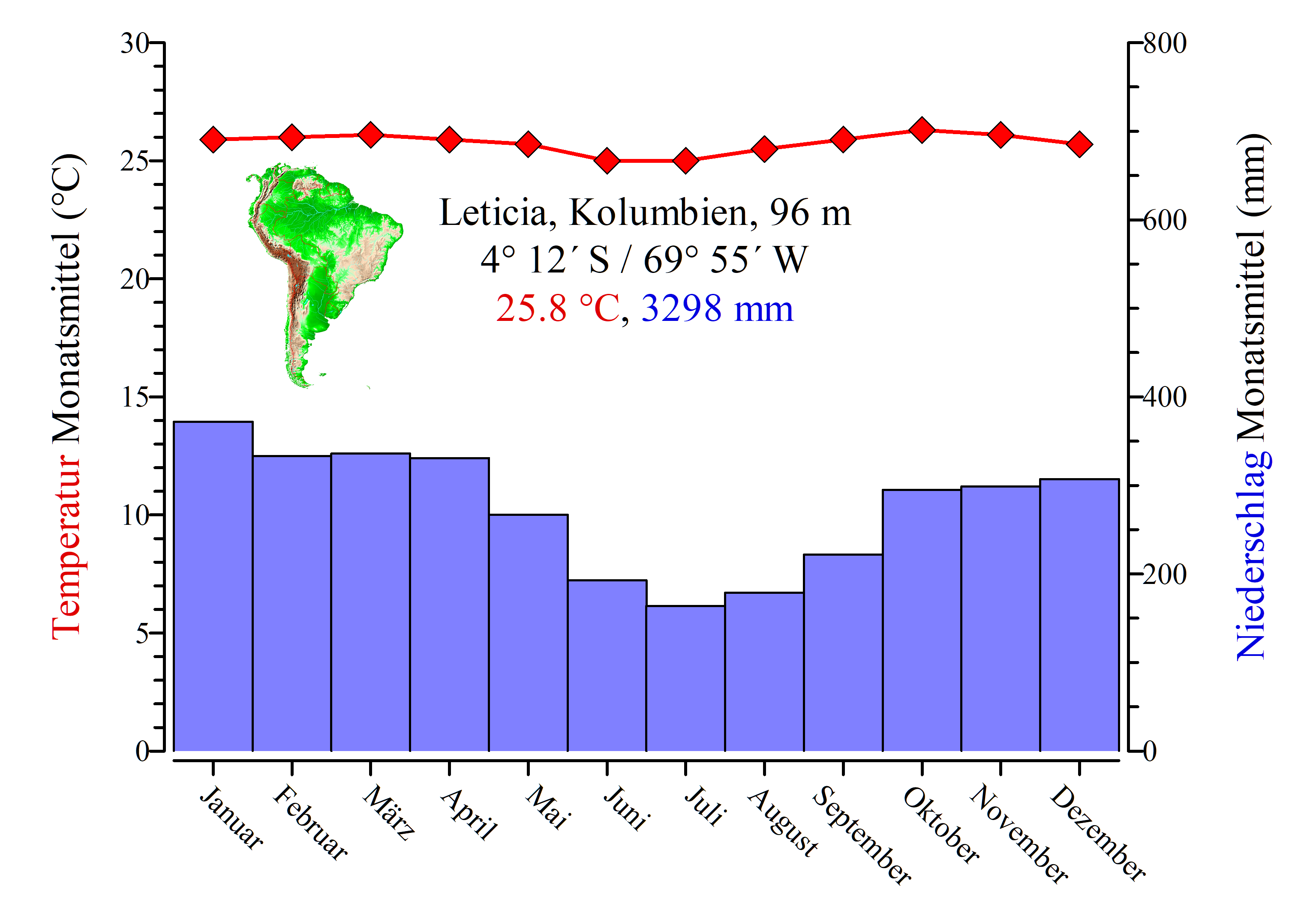
Das Flusssystem des Amazonas stellt das größte Süßwasserreservoir unseres Planeten dar. Das große, sich über eine Fläche von gut und gerne 7 Millionen km2 erstreckende Einzugsgebiet dieses größten Flusssystems der Erde ist trotz der gewaltigen Größe in seiner Hydrologie nicht so stabil, wie wir uns das vielleicht vorstellen. Im Jahresmittel entlässt der Amazonas ein riesiges Wasservolumen von ungefähr 175 000 m3 pro Sekunde in den Atlantik (Sioli 1984).

Das ist jedoch nur ungefähr ein knappes Drittel der Menge, die im Mittel pro Sekunde als Niederschlag auf dieses riesige Gebiet niedergeht. Der Rest verdunstet (Salati und Marques 1984), vor allem durch die Evaporation der Gegenwaldbäume. Rechnet man diese Mengen um, so kommt man auf die unvorstellbare Niederschlagsmenge von im Durchschnitt täglich ca. 7.5 Litern Regen pro Quadratmeter! Diese Niederschläge sind jedoch nicht gleichmäßig verteilt, sondern fallen – vor allem in südlichen und südwestlichen, weniger in den nordwestlichen Amazonaszuflüssen – zyklisch in den sogenannten Regenzeiten (Goulding et al. 2003).
Die Regenzeiten führen dazu, dass die Wasserstände der Hauptflüsse im Jahresverlauf im Mittel um 8 bis 10, im Extremfall um bis zu 17 Meter, die einiger südlicher Nebenflüsse maximal sogar um bis zu 20 Meter schwanken können (Sioli 1984). Die Ende 2005 in der Presse mit sensationellen Photos untermauerten Berichte über die extremen Niedrigwasserstände gab es übrigens schon – allerdings weit weniger reißerisch aufgemacht – zwei- bis dreimal im vorigen Jahrhundert. Allerdings werden im Zuge des Klimawandels die Extremwasserstände in Zukunft wohl häufiger auftreten.
Niederschlagsmengen und Temperatur:
Die Menge an Wasserdampf, die ein Volumen an Luft aufnehmen kann, ist von der Temperatur und vom Luftdruck abhängig. Nach der Magnusformel kann ein Kubikmeter Luft bei 31°C ungefähr 32 g Wasser aufnehmen, bei 35°C allerdings schon knapp 40 g. Wenn sich beim Abregnen die Luft um ca. 5°C abkühlt, aber trotzdem noch mit Wasserdampf gesättigt ist, fallen aus einem Kubikmeter Luft im ersten Fall 7.6 ml und im zweiten Fall schon 9.2 ml Regen. Das ist einer der Gründe, weshalb Niederschläge bei insgesamt höheren Temperaturen stärker ausfallen können.
Da Gewitterwolken mit mehreren hundert Metern sehr hoch sind, kommen in kurzer Zeit einige Liter pro Quadratmeter zusammen. Zusätzlich wandern Gewitter, so dass die Niederschläge auf bestimmten Flächen noch deutlich höher werden!
Auf diese Weise kommen beträchtliche Niederschlagsmengen zusammen, die sich an einigen Orten bis zu mehr als 4 000 Liter im Jahr pro Quadratmeter aufsummieren können. Dadurch, dass die Niederschläge, wie oben erläutert, nicht gleichmäßig fallen, kommt es zu ausgeprägten Regenzeiten mit Überschwemmungen.
Es kommt während der jährlichen Überflutungen zur Ausbildung ausgeprägter Überschwemmungsgebiete, sogenannter „floodplains“, die sich allein in Amazonien über eine Fläche von bis zu 200 000 Quadratkilometer, also mehr als die Hälfte der Fläche der Bundesrepublik, ausdehnen können (Goulding et al. 1995, Goulding et al. 2003). Diese Überschwemmungsgebiete weisen aufgrund des relativen Nährstoffreichtums, bedingt durch die sich teilweise zersetzenden Pflanzenbestandteile, eine sehr hohe Produktivität an Biomasse auf und werden deshalb sehr gerne von verschiedenen Fischarten zur Hochwasserzeit aufgesucht.

Die Regenzeiten hinterlassen in den anschließenden Trockenzeiten viele Gewässer, welche vom Hauptfluss abgeschlossen sind (Junk 1997, Irion et al. 1997). Gab es vorher viel Wasser pro Fisch, gibt es nun viel Fisch pro Wasser! Nicht alleine der fallende Wasserstand, die zunehmende Futterknappheit sowie die Bedrohung durch Räuber machen den eingeschlossenen Fischen das Leben schwer, sondern vor allem ein Faktor: die stark schwankende, unberechenbare und teilweise sehr niedrige Sauerstoffkonzentration.
Sauerstoff und Kiemenatmung?
Die Frage wozu denn ein Fisch Sauerstoff braucht haben Sie sich sicher noch nie gestellt, weil eigentlich schon jedem kleinen Kind klar ist, dass wir Sauerstoff bzw. „Luft“ zum „Atmen“ brauchen. Was aber ist Atmung genau? Was ist das Besondere bei der Atmung von Fischen?
Auf diese Frage gibt es mehrere Antworten: Wir können hier zwischen der „äußeren Atmung“, also dem Gasaustausch über die Kiemen (und andere Atemorgane) und der „inneren Atmung“, der Atmung in den Zellen, unterscheiden. Bei der „inneren Atmung“ wird in den Mitochondrien, den sogenannten „Kraftwerken der Zelle“, der überwiegende Teil des aufgenommenen Sauerstoffs reduziert und zusammen mit dem aus der Nahrung (aus den Kohlenhydraten) gewonnenen Wasserstoff (bzw. den Reduktionsäquivalenten) zu Wasser zusammengebaut. Die dadurch freiwerdende Energie wird zur Adenosintriphosphat-Synthese verwendet. Dieses ATP stellt im Organismus den universellen Energieträger dar. Durch Aufnahme und Abspaltung eines Phosphatrests kann dabei Energie auf andere Reaktionen übertragen werden, aber das wollen wir hier nicht weiter vertiefen.
Energie …
Sauerstoff und Wasserstoff sind ein sehr energiereiches Gemisch! Kaum ein anderes Gemisch enthält soviel Energie, wie wir aus technischen Anwendungen wie der Brennstoffzelle oder vielleicht noch aus der Schule von der Knallgasreaktion wissen. Sauerstoff ist zudem in nahezu unbegrenzten Mengen in der Atmosphäre vorhanden (ungefähr 20 % der Atmosphäre bestehen aus Sauerstoff). Leider gelangt ein Fisch nicht so leicht an den Sauerstoff wie wir als luftatmende Wesen. Das liegt daran, dass in Wasser – bei gleichem Sauerstoffpartialdruck – nur ca. 3 % bzw. ein Dreißigstel der Menge in Luft enthalten ist (Paul 2001).
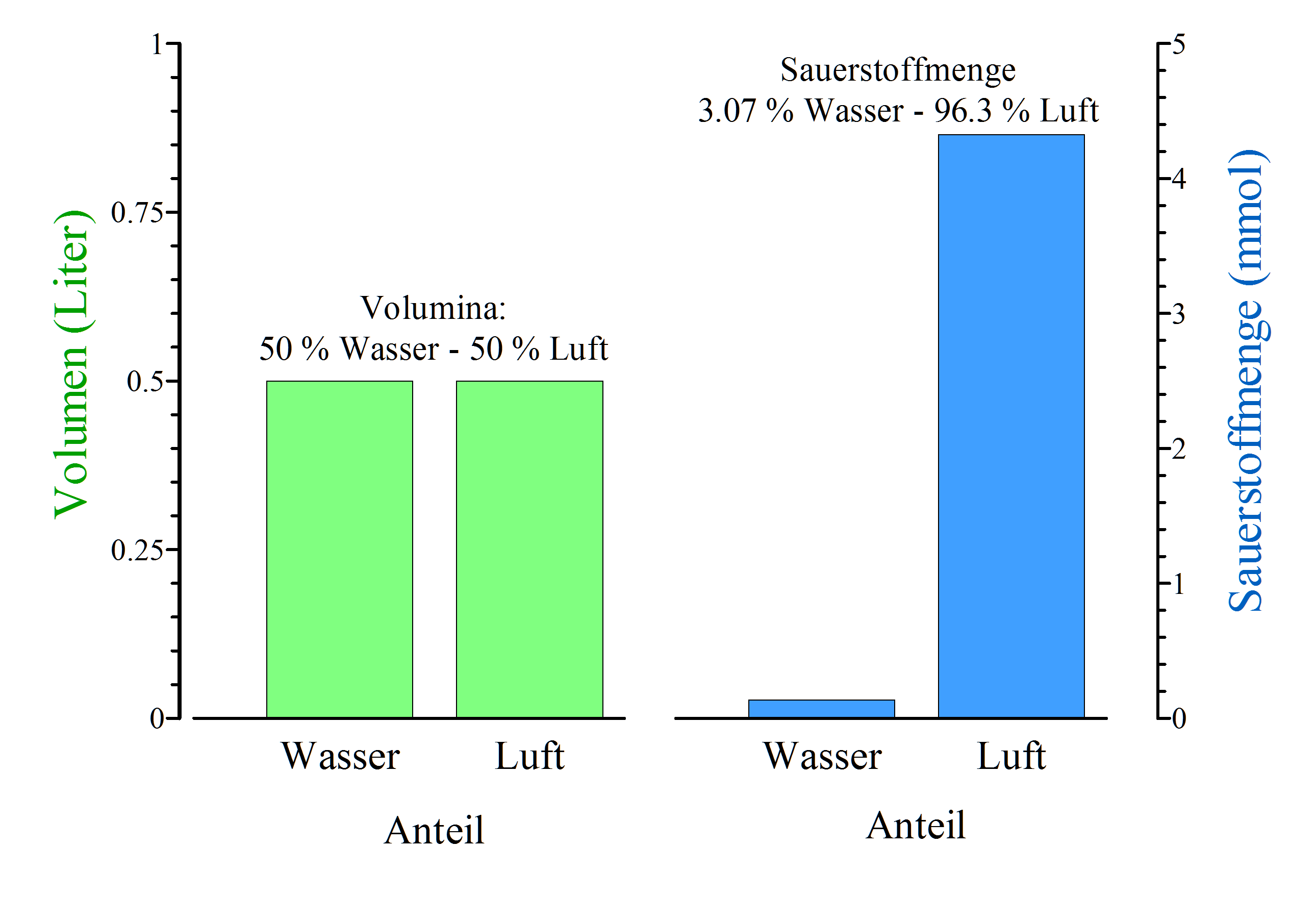
Um die unter unterschiedlichen physikalischen Umgebungsbedingungen (Temperatur, Salzkonzentration, Druck) gelöste Menge an Gasen in einem Medium (Luft, Wasser) zu beschreiben, hat sich der Begriff der Löslichkeit eingebürgert. Bitte beachten Sie jedoch, dass dieser Begriff oft nicht genau definiert ist und in der Literatur zum Teil unter unbestimmten bzw. ungenannten Umgebungsbedingungen (im besten Fall Standardbedingungen für die Messung physikalischer Größen für einen Liter Wasser bei 20°C und unter Normaldruck) angegeben wird.
Löslichkeit:
Die Löslichkeit \(\beta\) beschreibt die Anzahl an gelösten Sauerstoffmolekülen (\(M_{O_2}\) in µmol), die sich bei einem gewissen Sauerstoffpartialdruck (\(P_{O_2}\) in kPa) in einem gewissen Volumen (\(V\) in l) befinden:
\[ \begin{align} \beta = {M_{O_2} \over V \cdot P_{O_2}} \end{align}\]
Löslichkeit von Sauerstoff
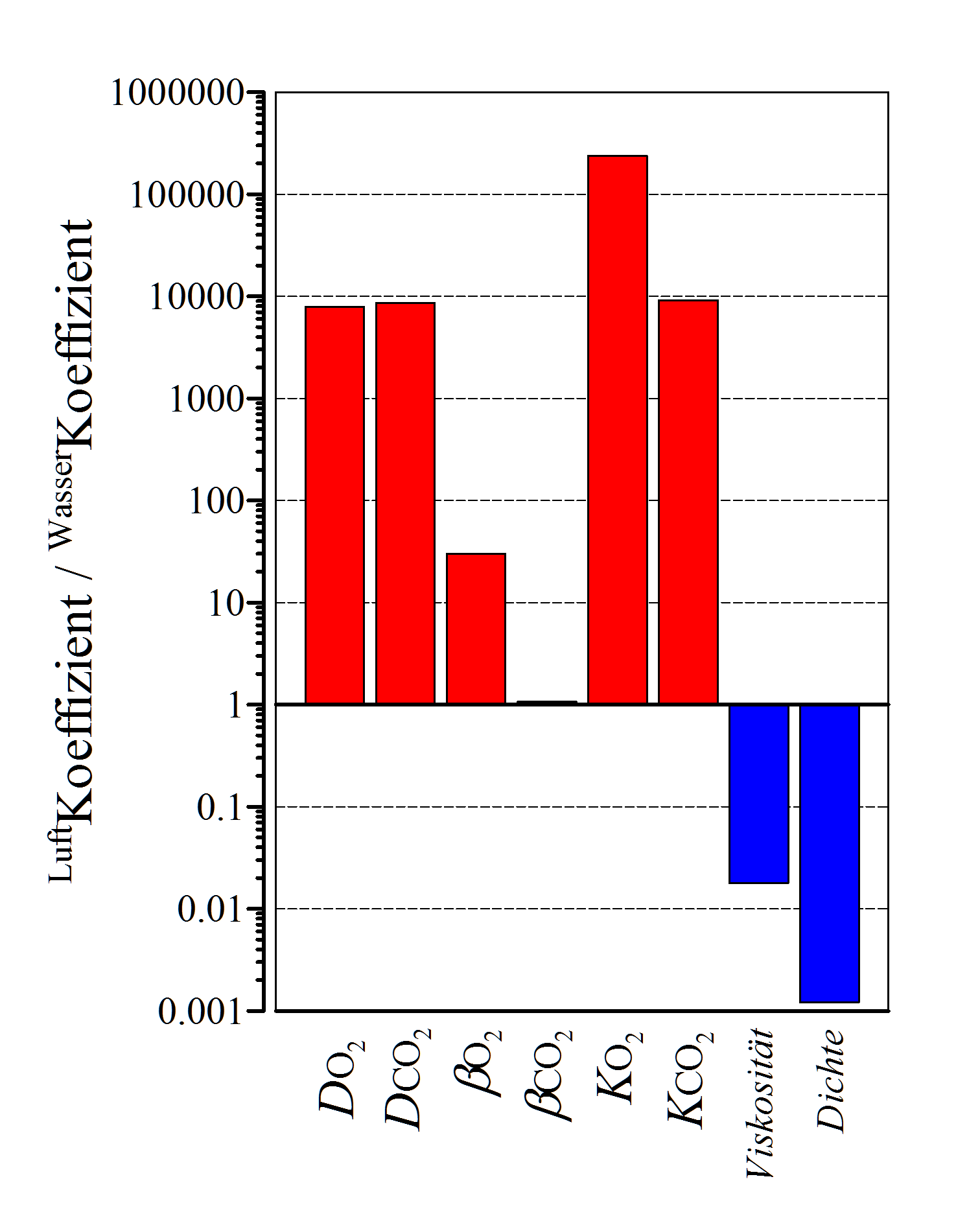
Die Löslichkeit eines Gases in einem wässrigen Medium hängt – wie oben erwännt – unter anderem von der Temperatur und von der Salzkonzentration ab. Je höher die Temperatur und je höher die Salzkonzentration, desto niedriger ist, bei gleichem Partialdruck, die Anzahl der gelösten Moleküle. Eine gebräuchliche Einheit für die Löslichkeit ist mmol/l kPa. Die Löslichkeit für Sauerstoff in Wasser bei 25°C beträgt ungefähr 0.013 mmol/l kPa, bei gleicher Temperatur in Luft ca. 0.4 mmol/l kPa, also das ca. 30-fache.
Zusätzlich zur niedrigeren Sauerstofflöslichkeit sind die Viskosität und die Dichte von Wasser bedeutend höher als von Luft (Hetz 2003), also Faktoren, die es einem Fisch nicht gerade erleichtern, an den im Wasser vorhandenen lebensnotwendigen Sauerstoff zu gelangen. Diese Tatsache ist wahrscheinlich auch ein Grund dafür, weshalb die Atmungsorgane der meisten wasserlebenden Tiere auf die Körperoberfläche verlegt sind und deshalb im Vorbeiströmen ventiliert, also vom Atemmedium durchspült werden.
Kiemen
In den Kiemen tritt das Wasser in sehr engen Kontakt mit dem Blut, welches vom Herz durch die Kiemen gepumpt wird. Das Blut strömt dabei in entgegengesetzter Richtung zum Wasser, was den Austausch des Atemgases Sauerstoff zwischen Wasser und Blut sehr effektiv macht. Dieser sogenannte „Gegenstromaustauscher“ ist im Tierreich aufgrund seiner Effektivität sehr weit verbreitet. Er gestattet durch die Ausnutzung des gesamten Austauschwegs eine sehr viel höhere Effizienz beim Atemgasaustausch als andere Austauschorgane. Die unidirektionale Ventilation verhindert ausserdem ein Totvolumen wie beim Atmen mit einer sackförmigen Lunge. Beim Menschen nimmt ein hoher Anteil der Luft (der in der Luftröhre und den Bronchien verbleibt) nicht am Gasaustausch teil.
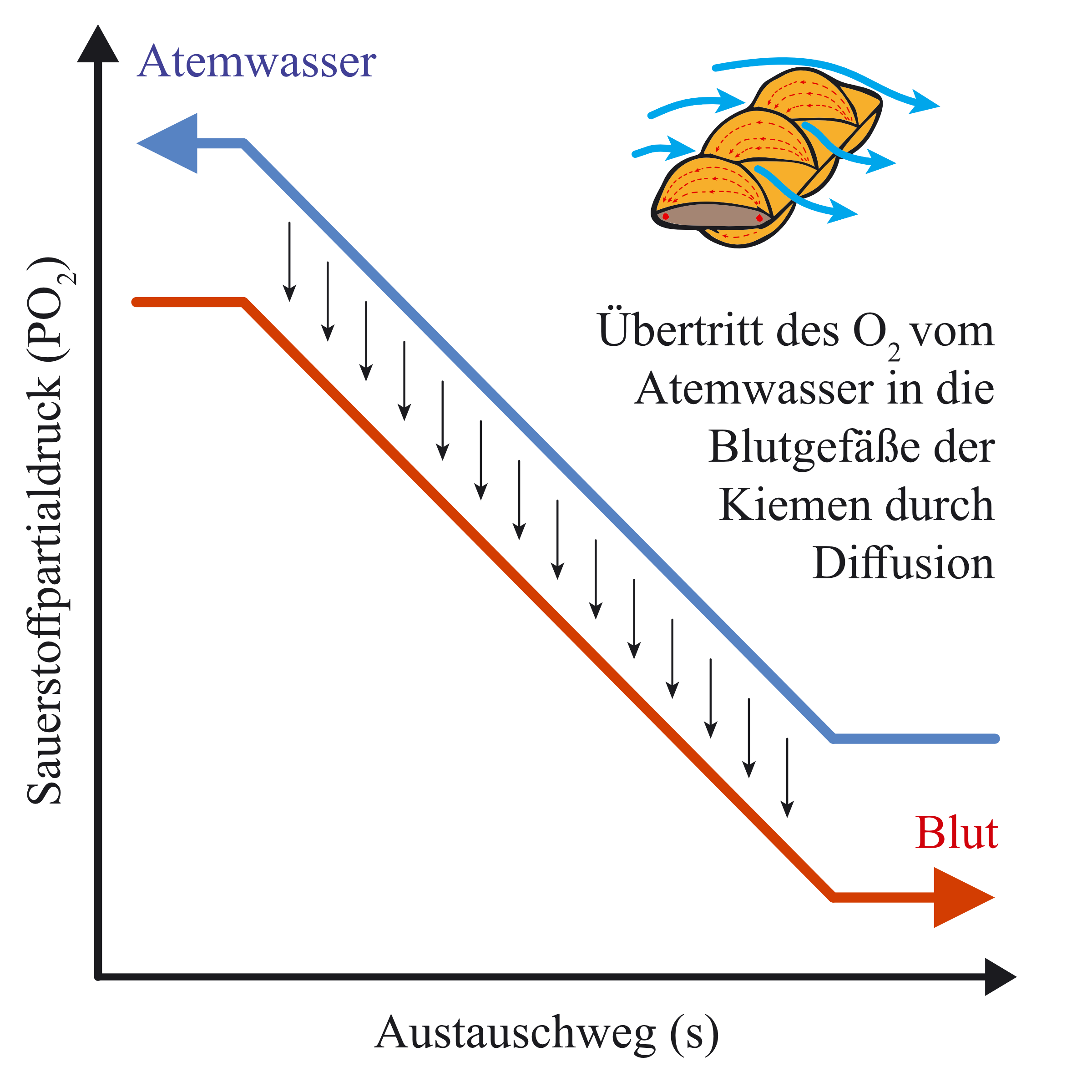
So können Fische in einem Durchlauf erheblich größere Anteile (bis zu 70%) an Sauerstoff aus dem Atemmedium Wasser herausholen als es für luftlebende Tiere möglich ist. Zum Vergleich: Der Mensch verwendet nur ca. 20% des eingeatmeten Sauerstoffes, der Rest wird wieder ausgeatmet (und kann sogar zur Atemspende genutzt werden). Trotz der hohen Effektivität der Kiemen muss ein Fisch jedoch sehr viel mehr Energie für die Kiemenventilation aufwenden als ein luftatmendes Lebewesen, da Wasser im Vergleich zu Luft ein sehr viskoses Medium ist. Einige Fische verwenden deshalb bis zu 30%, in besonderen Situationen sogar bis zu 70% ihrer Energie allein für die äußere Atmung, also die Durchströmung der Kiemen mit Atemwasser.
Viskosität:
Die Viskosität beschreibt die Zähflüssigkeit von Medien, hier für Wasser. Sie beschreibt unter anderem, wieviel Wasser bei einem definierten Druck durch eine Struktur fließen kann. Die Viskosität hängt in Wasser sehr stark von der Temperatur ab.
Warmes Wasser ist weniger zähflüssig. Bei gleichem Wasserleitungsdruck fließt zum Beispiel deutlich mehr warmes als kaltes Wasser durch eine Wasserleitung. Im Vergleich zu Gasen, wie der Luft, ist Wasser jedoch sehr viskos, weshalb es für wasserlebende Tiere mehr “Arbeit” erfordert, eine entsprechenden Menge an Wasser durch die Atemorgane zu transportieren.
Wieso kommt es in amazonischen Gewässern zum Absinken der Sauerstoffkonzentration?
In amazonischen Gewässern treten durch unterschiedliche Gründe Probleme in der Sauerstoffversorgung auf. Während schnell fließende, eventuell sogar durch Wasserfälle oder Katarakte unterbrochene Fließgewässer unterschiedlicher Größe meist eine Sauerstoffkonzentration im Bereich der Luftsättigung oder nur wenig darunter aufweisen, kann es bei sehr langsam fließenden sowie flachen, stehenden, oder mit einer Schwimmpflanzendecke bedeckten Gewässern zu sehr starken Schwankungen der Sauerstoffkonzentration kommen.

Der hauptsächliche Eintrag von Sauerstoff in ein Gewässer erfolgt aus der Atmosphäre: Wasser- und Luftbewegung sorgen für einen permanenten Austausch von Gasen zwischen Luft und Wasser. Im Wasser selbst überwiegt der Nettosauerstoffverbrauch meist die Sauerstoffproduktion durch aquatische Macrophyten.
Selbst wenn diese Pflanzen nicht fehlen, wie es aber in den meisten südamerikanischen Gewässern der Fall ist, tritt nachts ein Problem auf: Aufgrund der geringen Konzentration von Sauerstoff in Wasser von nur ca. 8.2 mg l-1 bei 25°C und einem Luftdruck von 760 mm Hg (Weiss 1970) kann während des Tages Sauerstoff nicht auf Vorrat hergestellt werden damit die Fische damit nachts über die Runden kommen.
Ein kleines Rechenbeispiel
Eine kurze Abschätzung soll dies verdeutlichen: Typische Sauerstoffverbrauchswerte bei kleinen Fischen liegen bei einer Temperatur von 25°C zwischen 0.06 und 0.35 ml g-1 h-1, also ungefähr 2 bis 10 µmol g-1 h-1 (Clarke und Johnston 1999). Die Sauerstoffverbrauchswerte sind, auf die Körpermasse bezogen, bei Fischen ungefähr um den Faktor 100 geringer als bei einem Säugetier vergleichbarer Größe (Hoppeler und Weibel 1998), was unter anderem an der niedrigeren Temperatur des Gewebes und der Tatsache, dass viele Fische eine weiße, also keine gut durchblutete und mit vielen Mitochondrien versehene rote Muskulatur besitzen, liegt.
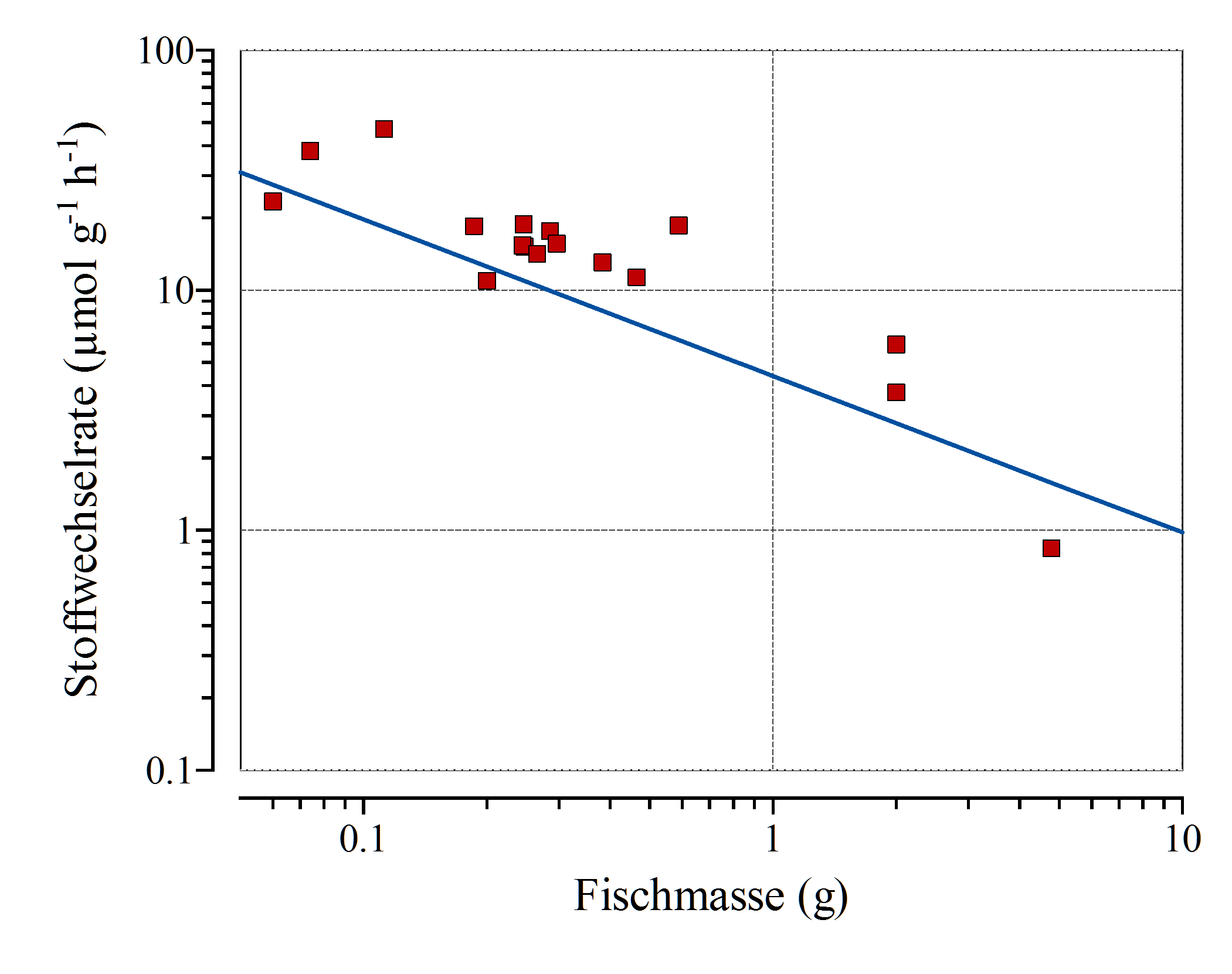
Größere Fische veratmen zudem auf ihre Körpermasse bezogen deutlich weniger Sauerstoff als kleine. Viele sehr kleine Fische mit einem Gesamtgewicht von 100 Gramm verbrauchen deshalb im Verlauf einer Nacht (eine Dauer von 10 h angenommen) beispielsweise mit ca. 350 ml Sauerstoff deutlich mehr als ein einziger großer Fisch mit der gleichen Körpermasse, der eventuell mit 60 ml Sauerstoff auskäme.
Ginge man von einer Sauerstoffkonzentration von 8.2 mg l-1 aus, so bräuchten die kleinen Fische ca. 42 Liter (350 geteilt durch 8.2), der große Fisch nur gut 7 Liter luftgesättigtes Wasser, um seinen Sauerstoffbedarf zu decken. Dabei ist aber nicht berücksichtigt, dass die Sauerstoffkonzentration natürlich nicht auf 0 mg l-1 sinken darf; man kann das benötigte Volumen also gerne verdoppeln!
Diese Abschätzung verdeutlicht die Notwendigkeit eines Sauerstoffeintrags aus der Atmosphäre, im Biotop genauso wichtig wie im Aquarium! Die Pflanzen verbrauchen zudem in der Nacht selbst Sauerstoff und konkurrieren deshalb mit den Fischen. Diese Umstände können deshalb im Laufe der Nacht zu einem sehr starken Abfall der Sauerstoffkonzentration führen, was bisweilen sogar in einer vollständigen Anoxie enden kann.
Tümpel und Lagunen …
Sehr viel größere Probleme als in Flüssen mit einer dauernden Wasserbewegung treten in den abgeschlossenen Tümpeln und Lagunen in Amazonien auf. Hier leben sehr viele Fische auf engstem Raum zusammen (Silvano et al. 2000, Galacatos et al. 2004). Wenn bereits Fische abgestorben sind und mikrobiell abgebaut werden, führt der große Sauerstoffverbrauch der abbauenden Bakterien trotz einer ausreichenden Sauerstoffversorgung der Tümpel zu einer chronisch niedrigeren Sauerstoffkonzentration (Hypoxie).
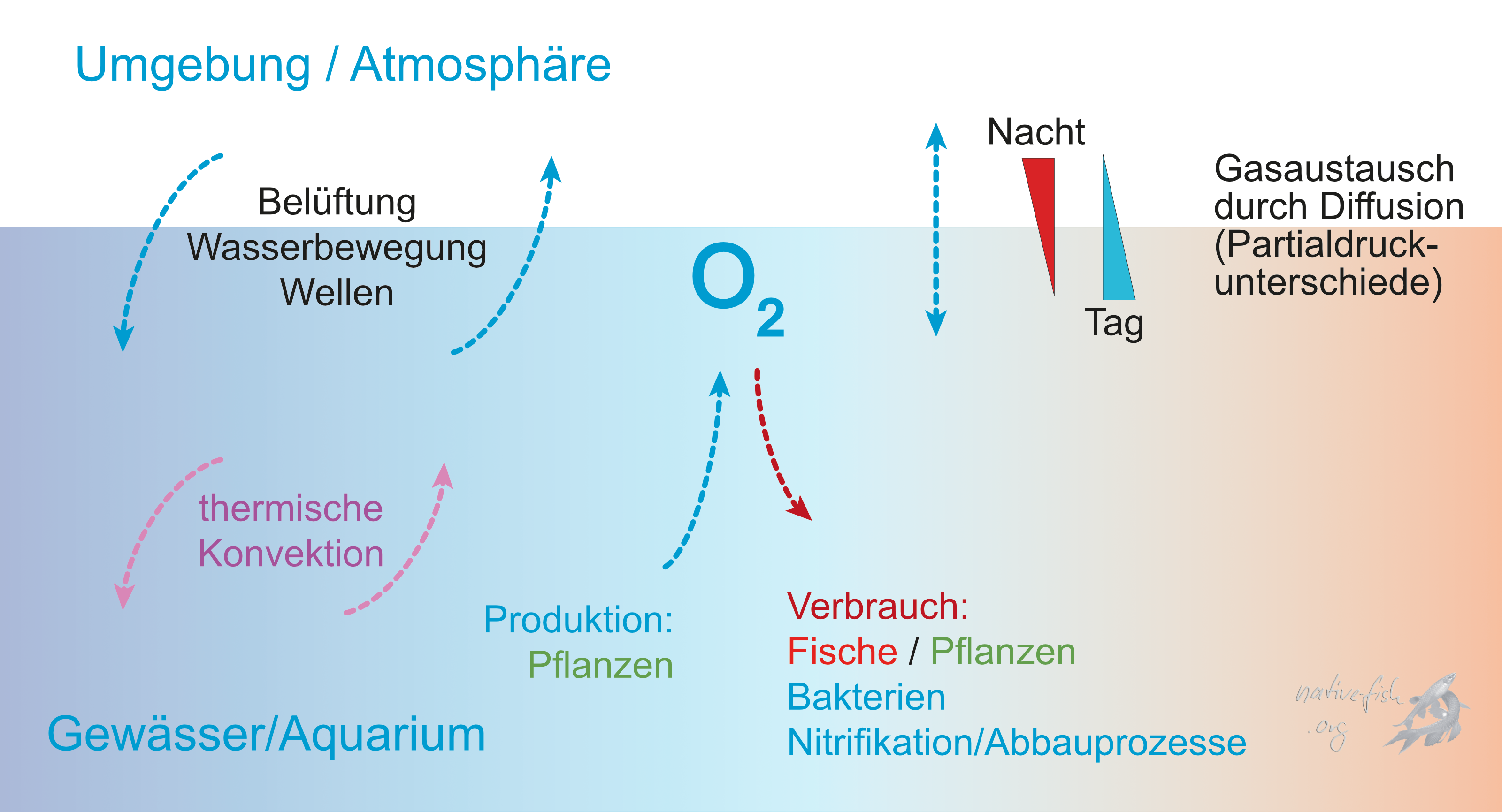
Werden diese Tümpel zudem noch stark besonnt oder fehlt die Windbewegung des Wassers zum Eintrag von Sauerstoff, so steigt der akute Sauerstoffverbrauch der Fische aufgrund der bei höheren Temperaturen erheblich erhöhten Stoffwechselrate stark an. Bei einer Temperaturerhöhung um ungefähr 10°C erhöht sich die Stoffwechselrate bei Fischen um den Faktor 3 bis 4 (also 300 bis 400 %); außerdem erniedrigt sich die Löslichkeit für Sauerstoff in Wasser um knapp 20 % (Weiss 1970) – urteilen Sie also selbst, was der Grund für die Sauerstoffknappheit ist: die geringere Löslichkeit oder der steigende Stoffwechsel? Die Fische atmen sich also gegenseitig den Sauerstoff weg und eine akute Hypoxie kann entstehen.
… und sogar im Aquarium
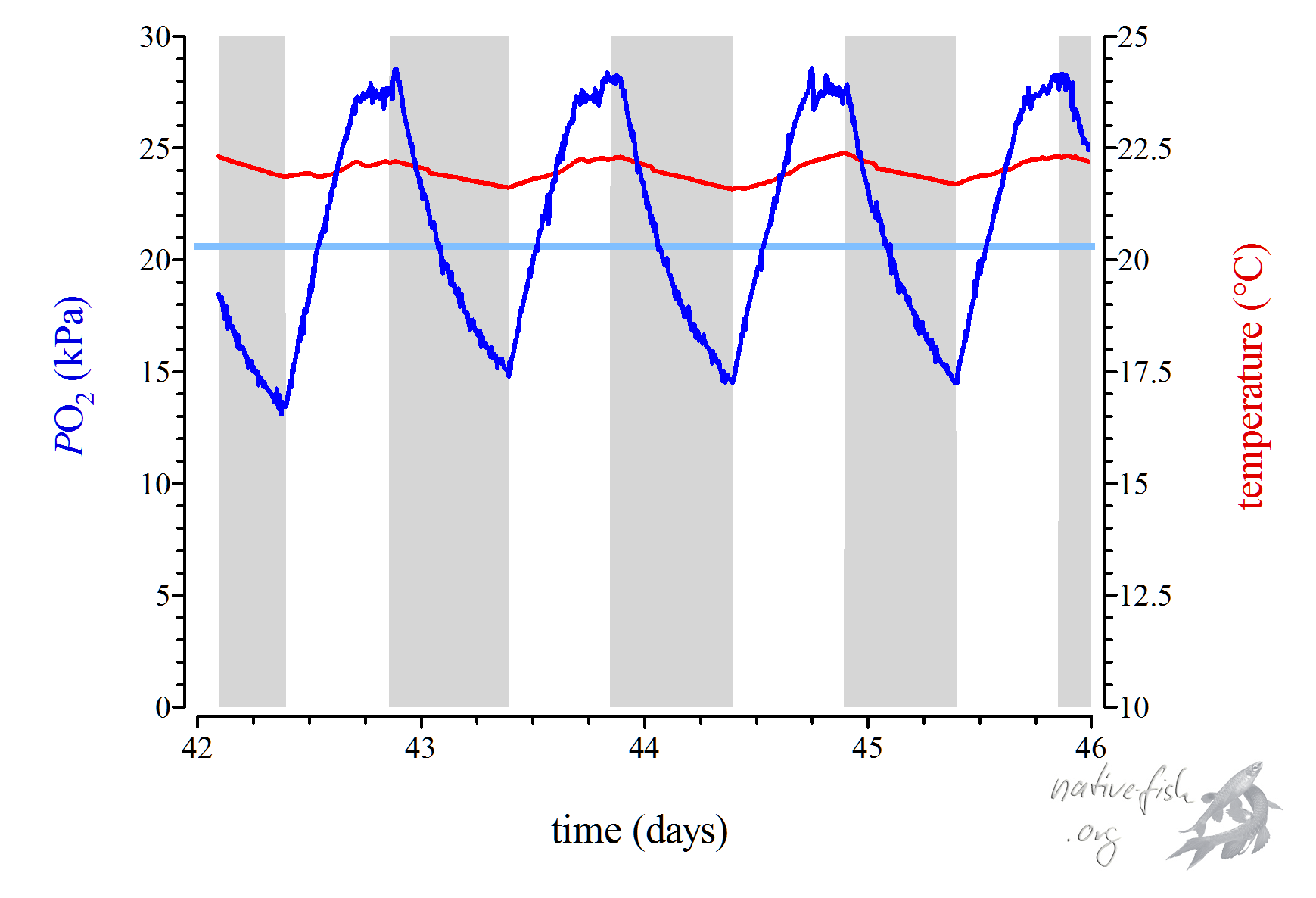
Bedingt durch eine dichte Bepflanzung kann es auch in einem gut gefilterten und bewegten Aquarium zu einer tagesperiodischen Schwankung des Sauerstoffpartialdrucks kommen. Wasserpflanzen atmen wie Fische und verbrauchen Sauerstoff, das gilt für den Tag und die Nacht. Die Wasserpflanzen assimilieren jedoch bei starker Beleuchtung und schaffen es dadurch, die Sauerstoffkonzentration durch Photosynthese zu erhöhen, was man auch messen kann. Nachts wiederum nehmen die Pflanzen wie die Fische nur Sauerstoff auf und es kommt zur Reduktion des Sauerstoffpartialdrucks. In der Grafik kann man diese Schwankungen gut erkennen. Sie sind deutlich aber harmlos für Fische und Pflanzen.
Wie begegnen die Fische dem Sauerstoffproblem?
Fische sind also als wasserlebende Organismen durch ihren Lebensraum einem wechselnden Sauerstoffangebot ausgesetzt. Wie kommen diese damit klar? Für Fische bestehen grundsätzlich vielfältige Möglichkeiten, dem Problem des wechselnden Sauerstoffangebots zu begegnen:
Drei wichtige Möglichkeiten für Fische, einer Hypoxie zu begegnen:
- Vermeidung
- Toleranz
- Anpassung
Migration
Die Migration stellt eine Vermeidungsstrategie dar. Die einfachste Möglichkeit für die Fische besteht darin, rechtzeitig dafür zu sorgen dass sie zu Beginn der Trockenzeit nicht in einer Lagune oder einem Tümpel mit niedriger Sauerstoffkonzentration gefangen werden, sondern in die Flüsse ausweichen können. Was für uns zunächst logisch und einfach klingt, ist eine bemerkenswerte Strategie: Die Fische müssen den Sauerstoffpartialdruck oder einen damit verbundenen Parameter in der Umgebung messen, ihn bewerten und dann eine Entscheidung treffen. Zudem müssten die Fische ja wissen, ob sie sich an einer Stelle befinden, die später zum Tümpel wird?
Bei der Auslösung solcher Wanderungen spielen sicher fallende Wasserstände und die damit verbundenen komplexen Änderungen im Ökosystem wie z.B. Futterknappheit eine größere Rolle als eine abnehmende Sauerstoffkonzentration (Jepsen et al. 1997, Winemiller und Jepsen 1998, Duque et al. 1998, Sato et al. 2000); der Effekt bleibt aber der gleiche. Die Fische wandern in andere Habitate. Unter den amazonischen Fischen befinden sich sehr viele wandernde Arten, allerdings ist noch nicht systematisch untersucht worden, ob wandernde Fischarten („migratory fishes“) generell andere Ansprüche an das Sauerstoffangebot aufweisen als standorttreue Arten.
Verhaltensänderung
Wenn der Sauerstoff knapp wird, ist es angeraten, den Sauerstoffverbrauch zu senken, indem die körperlichen Aktivitäten auf ein Minimum reduziert werden. Dies ist auch bei Fischen feststellbar. Kräftezehrende körperliche Aktivitäten, wie Schwimmen, Balzen und auch aktive Futtersuche bzw. die Jagd nach Futter fallen weg. Die Fische tolerieren den geringeren Sauerstoffpartialdruck, stehen knapp unter der Wasseroberfläche und bewegen sich möglichst wenig.

Interessant ist, dass es einige Fischarten offenbar vorziehen, eher mit geringerem Sauerstoffangebot zu leben, als sich in die Gefahr zu begeben, von einem Vogel oder Fisch gefressen zu werden! Sloman et al. (2006) untersuchten das Verhalten von Astronotus ocellatus auf Hypoxie. Dabei stellten sie in einem Wahlversuch fest, dass vor allem Jungfische, obwohl diese aufgrund ihres höheren massenspezifischen Verbrauchs von Sauerstoff und ihrer geringeren Toleranz gegenüber hypoxischen Werten mehr auf eine Hypoxie reagieren sollten, bei einer Absenkung des Sauerstoffpartialdrucks eher Verstecke wählten, in denen sie von oben geschützt waren.
Im Aquarium im Labor mit einem Sauerstoffgradienten zwischen belüftetem (normoxischem) und nicht mit Sauerstoff gesättigtem (hypoxischen) Wasser hielten sie sich bevorzugt unter einer Decke von Schwimmpflanzen (Pistia stratiotes) auf, selbst wenn dort deutlich weniger Sauerstoff zur Verfügung stand.
Senken des Sauerstoffbedarfs
Mit den oben genannten Verhaltensänderung kann bei einigen Fisch eine aktive Senkung der Metabolismusrate und damit eine Absenkung des Sauerstoffverbrauchs unter die normalen Verbrauchswerte einhergehen. Gut untersucht wurde dieser Anpassungsvorgang bei Astronotus ocellatus, einem Fisch, der nicht nur in Aquarianerkreisen, sondern mittlerweile auch in der Wissenschaft als „Oskar“ bezeichnet wird. Bei Astronotus sinkt die Sauerstoffaufnahmerate mit abnehmender Sauerstoffkonzentration im Wasser (bis auf 0.47 mg l-1) um ungefähr 60% ab (Muusze et al. 1998). Gleichzeitig erhöht sich bei Astronotus die Konzentration von Glucose (Traubenzucker) im Blut um das dreifache, da Glycogen (die Speicherform des Traubenzuckers bei Tieren) aus der Leber mobilisiert wird.

Die Energie, die ja weiterhin für einige Stoffwechselvorgänge gebraucht wird, wird bei solchen niedrigen Sauerstoffkonzentrationen ohne die Beteiligung von Sauerstoff (anaerob) durch Milchsäuregärung, einen Stoffwechselweg, der ohne Sauerstoff auskommt, aus der Glucose gewonnen. Entsprechend hoch steigt die Konzentration von Lactat (Milchsäure) im Blutplasma an (Chippari-Gomes et al. 2005). Diskusfische der Art S. aequifasciatus zeigten übrigens ganz ähnliche Verhaltensweisen wie Astronotus, ohne allerdings deren extreme Hypoxietoleranz zu erreichen. Diskusfische halten also in der Natur einiges aus. Wenn sie also die Kiemendeckel häufiger als sonst bewegen, muss es allerdings nicht immer gleich eine Sauerstoffknappheit sein!
Änderung der Atmungstätigkeit
Wie auch Menschen in Situationen, in denen Sauerstoffverfügbarkeit knapp werden kann (zum Beispiel beim Bergsteigen im Hochgebirge), so reagieren auch Fische auf eine akute Erniedrigung der Sauerstoffkonzentration zunächst mit einer Erhöhung der Atemfrequenz, die man an der Bewegung der Kiemendeckel erkennen kann. Durch die Erhöhung der Atemfrequenz wird pro Zeiteinheit mehr Wasser durch die Kiemen geleitet und somit die niedrigere Sauerstoffkonzentration im Atemwasser durch eine höhere Ventilationsrate kompensiert. An Fischen kann die Erhöhung der Atemfrequenz relativ leicht an der Bewegung der Kiemendeckel abgelesen werden. Bei Diskusfischen erhöhte sich zum Beispiel die Atemfrequenz von ca. 60 Schlägen min-1 in einem Wasser mit ca. 6 mg l-1 Sauerstoff auf ungefähr das doppelte (120 min-1) in einem Wasser, welches nur noch knapp 1 mg l-1 Sauerstoff aufwies (Chippari-Gomes et al. 2005).
An Hypostomus regani wurde festgestellt, dass die Effektivität, mit der Sauerstoff aus dem Wasser entzogen wird, bei niedrigen Sauerstoffkonzentrationen ansteigen kann. So steigt die Effizienz der Sauerstoffaufnahme von ca. 20% bei nahezu vollständig mit Luft gesättigtem Wasser – die Fische atmen dabei relativ “flach”, das Atemzugvolumen ist also eher niedrig – auf ungefähr 50% wenn die Sauerstoffkonzentration auf unter 1 mg l-1 sinkt (Mattias et al. 1998). Interessanterweise kann es bei anderen Fischen gerade umgekehrt sein. Der Ausnutzungsgrad (das Verhältnis zwischen dem im Wasser, welches durch die Kiemen strömt, enthaltenen Sauerstoff und der Sauerstoffaufnahme aus diesem Wasser) sinkt bei Hoplerythinus bei den gleichen Sauerstoffkonzentrationen von ungefähr 70% auf 20% (Oliveira et al. 2004). Fische nehmen also bis zu 70% des im Kiemenwasser transportierten Sauerstoffs auf.
Es gibt auch experimentelle Hinweise dafür, dass sich morphologische Parameter der Kiemen, zum Beispiel die Kiemenoberfläche, unter gewissen Umständen ändern kann (Fernandes und Perna-Martins 2001), was wiederum Auswirkungen auf die Sauerstoffaufnahme der Fische hat. Die für die Atmung zuständigen Kiemenoberfläche ist bei amazonischen Fischen sehr unterschiedlich ausgebildet. Die Werte schwanken, um ein Beispiel zu geben, zwischen ungefähr 115 000 mm2 kg-1 bei Piaractus mesopotamicus und 330 000 mm2 kg-1 bei Hoplias malabaricus (Severi et al. 1997). Es ist seit längerem bekannt, dass besonders die Ionenregulation, die auch in den Kiemen stattfindet, mit zwei wichtigen Parametern in die Atmung eingreift. Ich hatte an anderer Stelle schon über die Probleme der Ionenregulation in weichem Wasser berichtet (Hetz 2005) und auch im Schwarzwasserbeitrag auf diesen Seiten findet sich einiges dazu.
Setzt man Fische sehr ionenarmem Wasser aus, so ändern sich bei einigen Arten bestimmte morphologische Parameter der Kiemen (zusammengefasst von Kokoscha 2005). Die Kieme sondern teilweise Schleim ab und werden dadurch dicker und für Ionen aus dem Körper weniger durchlässig. Chloridzellen, die für die Aufnahme von Ionen aus dem Wasser nötig sind, wachsen bei einigen Fischarten stark an und erschweren somit (zumindest zum Teil) zusammen mit der dickeren Schleimschicht die Sauerstoffaufnahme aus dem Wasser (Fernandes et al. 1998, Fernandes und Perna-Martins 2001, Fernandes und Perna-Martins 2002). In extrem weichem Wasser ist also sowohl der Ionenverlust reduziert als auch die Sauerstoffaufnahme beeinträchtigt. Diesen Zusammenhang nennt man den Osmorespiratorischen Kompromiss (engl. Osmorespiratory Compromise, vgl. Robertson et al. 2015). Die reduzierte Möglichkeit, Sauerstoff über die Kiemen aus dem Wasser aufzunehmen, scheint also gegen den geringeren Ionenverlust aufgewogen zu werden.
Es ist aber nicht bei allen Fischen so einfach zu erklären. So erhöht die Salmlerart Hoplias malabaricus in destilliertem Wasser den Sauerstoffverbrauch um ca. 50% (Sakuragui et al. 2003), das Atemverhalten ändert sich aber nicht wie erwartet. Trotz gegenüber normalem Wasser erhöhtem Sauerstoffverbrauch war der Ausnutzungsgrad des Sauerstoffs in den Kiemen bei destilliertem Wasser beträchtlich gestiegen, Untersuchungen der Kiemen bestätigten frühere Untersuchungen des ungewöhnlichen Befunds (Moron et al. 2003), dass diese aufgrund einer größeren Oberfläche in destilliertem Wasser für die Sauerstoffaufnahme besser funktionierten. Sie sehen also, man kann selbst im gleichen Biotop nicht von einer Fischart auf die ganze amazonische Artenfülle an Fischen schließen!
Veränderung der Blutzusammensetzung
Das weiter oben genannte Gegenstromprinzip der Fischkieme ist nur ein Grund für die hohe Sauerstoffausbeute in der Fischkieme, ein weiterer Grund ist die relativ hohe Sauerstoffaffinität des Fischblutes. Eine hohe Affinität bedeutet, dass das Blut die Fähigkeit besitzt, schon bei sehr niedrigen Sauerstoffkonzentrationen im Wasser eine große Menge von Sauerstoff an den Blutfarbstoff Hämoglobin zu binden und das Blut nahezu vollständig mit Sauerstoff zu sättigen. Diese, im Vergleich zu menschlichem Hämoglobin sehr viel höhere Sauerstoffaffinität des Hämoglobins ermöglicht es den Fischen tägliche, teilweise extreme Schwankungen des Sauerstoffpartialdrucks zu tolerieren. Interessanterweise ist die Sauerstoffkapazität des Fischbluts, also die Menge Sauerstoff, die maximal von einem definierten Volumen an Blut aufgenommen werden kann, bei Fischen oft etwas geringer als bei Menschen (Avilez et al. 2004), kann sich aber relativ rasch anpassen. Corydoras paleatus, zwar nicht unbedingt eine amazonische Art, zeigte höhere Hämoglobinkonzentrationen in Gewässern, in denen niedrigere Sauerstoffkonzentrationen auftreten konnten (Cazenave et al. 2005).
In der Tat lässt das Blut der Fische Zusammenhänge zwischen der Sauerstoffaffinität und der Stabilität der Biotope im Bezug auf den Sauerstoffpartialdruck erkennen. Das Blut von Fischen aus Biotopen mit Schwankungen des Sauerstoffpartialdruckes, also aus relativ kleinen eher labilen Gewässern weist eine deutlich erhöhte Sauerstoffaffinität und oft auch erhöhte Sauerstoffkapazität auf und bietet somit genügend Sicherheitsreserven gegen akute niedrige Sauerstoffkonzentrationen.
Oberflächenatmung
Oberflächenatmung ist bei amazonischen Fischen recht weit verbreitet. Auch im Aquarium kann man Oberflächenatmung beobachten, nämlich dann, wenn die Fische bei niedrigen Sauerstoffkonzentrationen an der Wasseroberfläche “hängen”. Nur sehr wenige Fische versuchen dann Luft zu schlucken; die weitaus meisten Arten nutzen die Tatsache dass die oberste Wasserschicht etwas mehr Sauerstoff enthält, der durch Diffusion in die oberflächennahen Wasserschichten eindringt, und atmen deshalb bevorzugt diese oberen Schichten.

Bei Kropfsalmlern (Triportheus) und auch bei Salmlern der Familie Lebiasinidae kann man dieses Verhalten vor allem bei hohen Temperaturen und Sauerstoffarmut bisweilen beobachten, aber auch Cichliden und Welse können dieses Verhalten zeigen. Amazonische Fische haben, um diese oberen sauerstoffhaltigen Wasserschichten optimal ausnutzen zu können, verschiedene Anpassungen entwickelt. Die wohl auffälligste Form der Anpassung ist ein tellerartiges Aufschwellen der Unterlippe, so dass diese zu einer Trichterform erweitert wird. Die Ausbildung der Unterlippe zu einem Trichter geht relativ rasch vonstatten. Schon nach 2 bis 6 Stunden nachdem im Experiment die Sauerstoffkonzentration auf ca. 20% der Luftsättigung erniedrigt wurde kann die Unterlippe vollständig ausgebildet sein (Sundin et al. 2000).

Zunächst hatte man vermutet dass diese gut durchbluteten Unterlippen selbst der Sauerstoffaufnahme dienen was sich aber mittlerweile als falsch herausgestellt hat. Diese tellerförmlichen Unterlippen dienen bei den verschiedenen Fischgruppen (alles fast ausschließlich Salmler, wie z.B. Kropfsalmler und Pacú) vielmehr dazu, das Wasser von der Oberfläche als dünnen Film in den Mundraum einströmen zu lassen und somit das sauerstoffreichere Oberflächenwasser möglicherweise beim Einströmen in den Mundraum zusätzlich zu oxygenieren (mit Sauerstoff zu versorgen).
Luftatmung
Haben alle bisherigen Beispiele der Anpassung an niedrige Sauerstoffverfügbarkeit gezeigt, wie die Tiere den Sauerstoff selbst bei niedrigen Sauerstoffkonzentrationen aus dem Wasser entnehmen können, so sind nicht wenige amazonische Fischarten dazu in der Lage, Sauerstoff aus der Luft aufzunehmen.
Generell sind im Körper eines Fisches alle gut durchbluteten Organe in der Lage Sauerstoff aufzunehmen und so die Kiemenatmung zu unterstützen oder zu ersetzen. Eine Übersicht über die Organe gibt Graham (1997). Gut durchblutet sind vor allem der Resorption dienende Epithelien wie Vorder-, Mittel-, und Enddarm, also sollten auch diese Organe selbst sowie die direkt mit Ihnen in Verbindung stehenden oder von ihnen abgeleiteten Organe (Kiemen, Schwimmblase, Darmdivertikel) zur Sauerstoffaufnahme befähigt sein. So wunderte es weiter nicht, dass bei sekundär luftatmenden Fischen vor allem Bereiche des Vorderdarms (Labyrinth, Schwimmblase) oder des Mitteldarms (sowie Mitteldarmdivertikel) zur Luftatmung dienen.
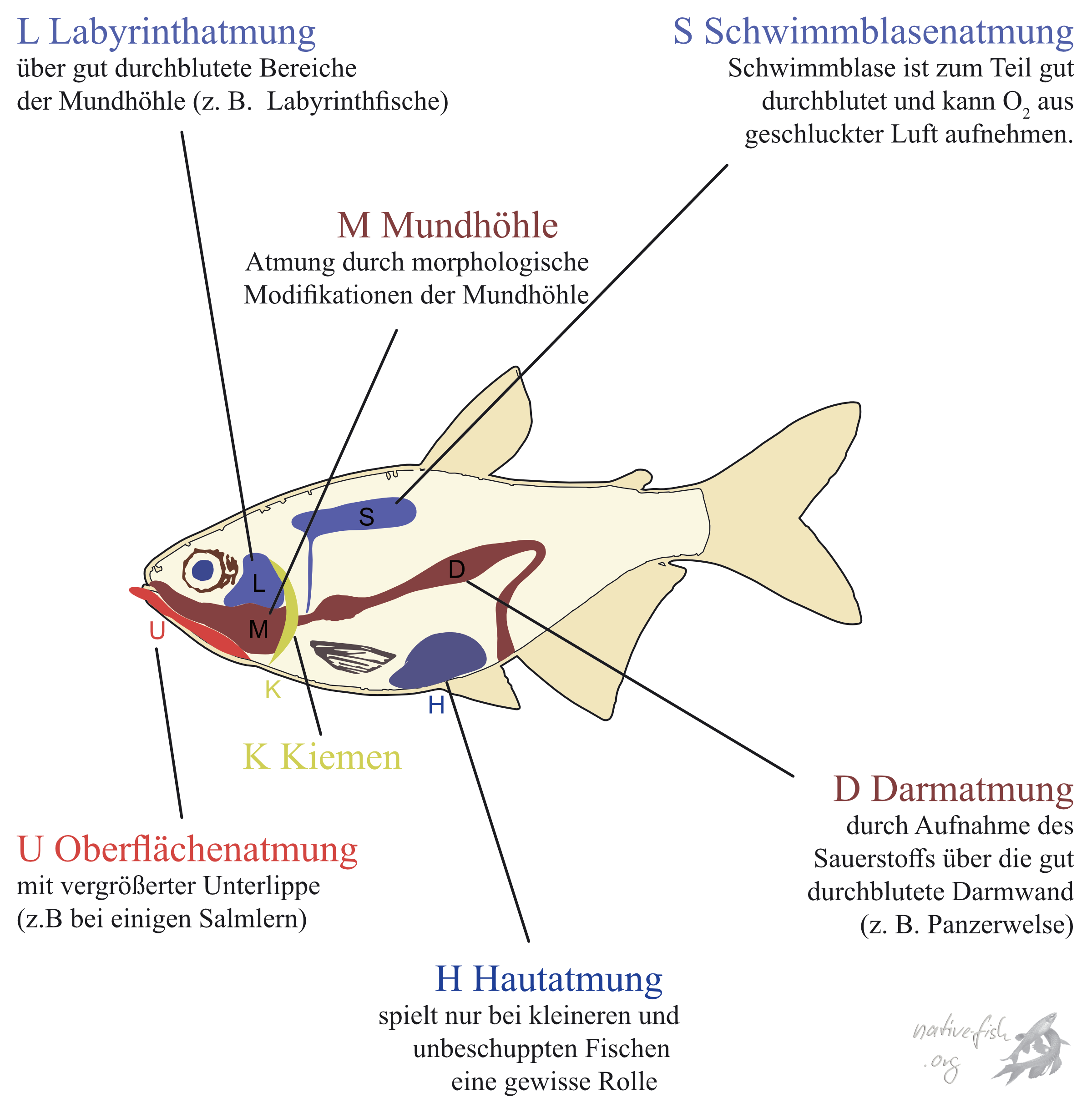
Hoplerythrinus nutzt zum Beispiel einen gut durchbluteten Bereich seiner Schwimmblase, um zusätzlich zur Kiemenatmung an Sauerstoff zu gelangen (Oliveira et al. 2004). Fällt die Sauerstoffkonzentration unter 3 mg l-1, so fängt der Fisch an, zunehmend häufiger an die Oberfläche zu kommen und Luft zu schlucken, die er dann durch den „ductus pneumaticus“ (einen Gang, der den Vorderdarm mit der Schwimmblase verbindet) in die Schwimmblase presst, um den Sauerstoff in einem stark durchbluteten Bereich der Schwimmblase an das Hämoglobin zu binden.
Paradoxerweise hat sich eine der bekanntesten Arten aus Amazonien, Arapaima gigas, so stark an die Luftatmung angepasst, dass er zu einem obligaten Luftatmer geworden ist (Brauner et al. 2004). Im Verlauf der Entwicklung versuchen diese Fische sogar zu verhindern dass der Sauerstoff, den sie zuvor aus der Luft mit Hilfe ihrer sehr stark durchbluteten Schwimmblase aufgenommen haben, über die Kiemen wieder zu verlieren, in denen sie die Kiemendurchblutung und die Kiemenoberfläche reduzieren.

Unter den Welsen findet man sehr viele fakultative Luftatmer, Fische also, die nur zu be-stimmten Zeiten oder unter bestimmten Bedingungen zur Luftatmung übergehen. Die meisten atmen Luft wenn sie kurz die Wasseroberfläche durchstoßen. Im Aquarium kann man dieses Verhalten bei Welsen der Gattung Corydoras relativ häufig beobachten. Die Panzerwelse kommen in Gruppen an der Wasseroberfläche um Luft regelrecht zu schlucken. Die Luft wandert dabei in den Darm wo sie durch die mit der stark durchbluteten Oberfläche in Kontakt kommt und dabei den Sauerstoff an das Blut abgibt (Podkowa und Goniakowska-Witalinska 2002). Auch unter den ancistrinen Welsen gibt es sehr viele Luftatmer, zumindest bei Arten, die in potentiell sauerstoffärmeren Gewässern leben. Diese Welse verwenden ebenfalls den Darm oder Magen zur Luftatmung (Podkowa und Goniakowska-Witalinska 2003). Inwiefern Welse, in großen Fließgewässern gefangen werden, Unterschiede in Sauerstoffverbrauch und der Möglichkeit der Luftatmung besitzen, ist derzeit noch nicht untersucht.
Ausblick
In diesem Bericht habe ich versucht, verschiedene Aspekte der Sauerstoffverfügbarkeit in natürlichen amazonischen Gewässern und die Reaktion der Fische darauf aufzuzeigen. Ich hoffe es ist mir gelungen, klarzustellen, dass Fische nicht immer die physiologisch optimalen Sauerstoffkonzentrationen in der Natur vorfinden, aber eben verschiedene Möglichkeiten und Strategien entwickelt haben, um zur Not auch bei einem geringeren (oft sogar bei einem sehr geringen) Sauerstoffangebot überleben zu können. Die von uns in Aquarien in menschlicher Obhut gehaltenen Fische finden – natürlich eine verantwortungsvolle Pflege vorausgesetzt – im Hinblick auf die Sauerstoffversorgung weitaus günstigere Bedingungen als in der Natur vor. Vielleicht trauen wir den von uns gehaltenen Fischen im Hinblick auf den Sauerstoff auch zu wenig zu?
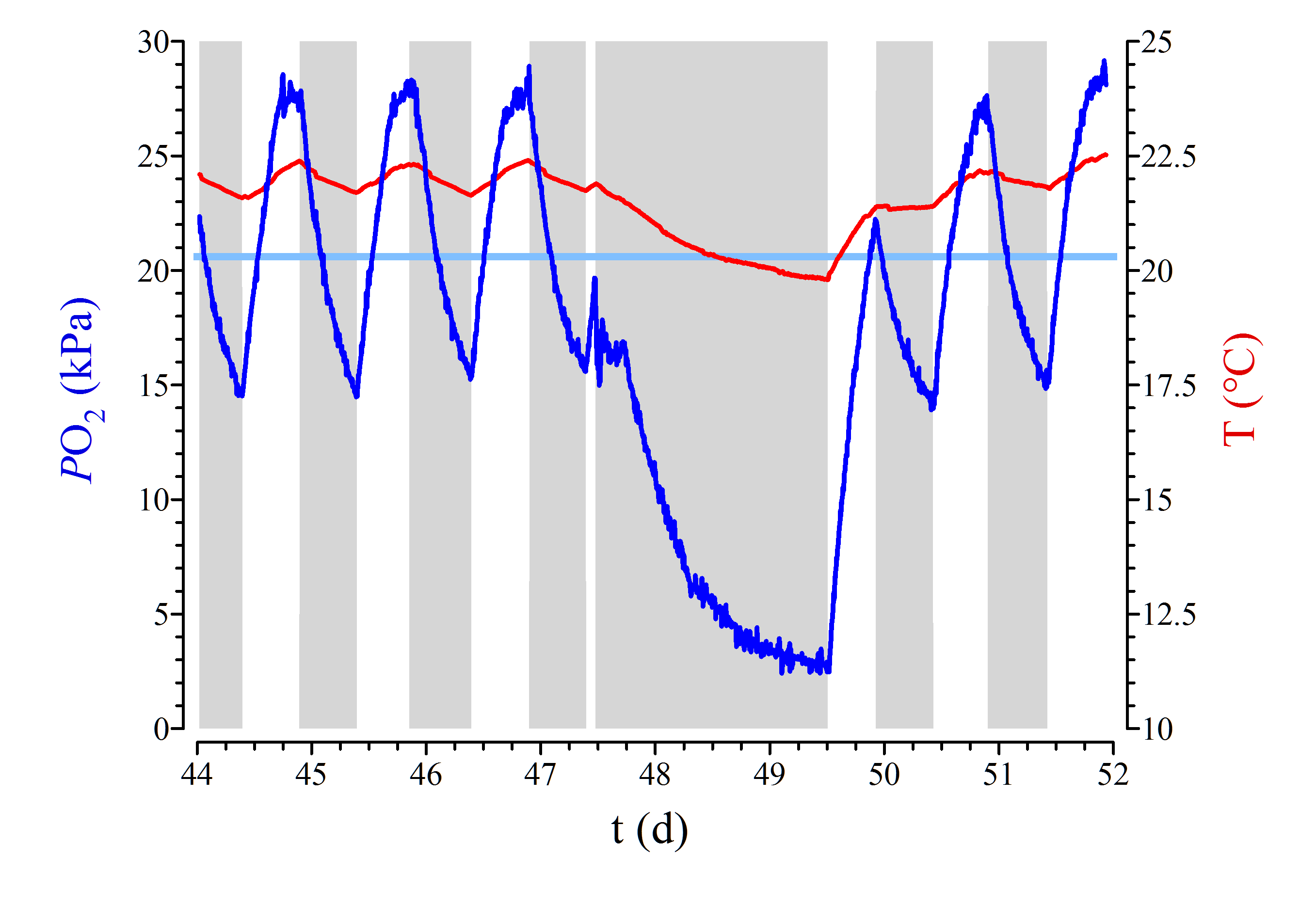
Trotzdem kann es im Aquarium zu gefährlichen Situationen kommen: Durch zu starken Besatz, zu starkes Füttern und den Ausfall von technischen Geräten wie im oben gezeigten Beispiel. Wir habe dazu mittlerweile eine Arbeit veröffentlicht (Mieske & Hetz 2020). Wenn dann jedoch die Besatzdichte nicht zu hoch ist und das Aquarium bei gegebenem Volumen eine genügend große Oberfläche aufweist, kann selbst bei einer technischen Panne nicht viel passieren, da der Sauerstoff durch Diffusion über die Wasseroberfläche eintritt.
Literatur
Avilez, I. M., Altran, A. E., Aguiar, U. H. und Moraes, G. (2004). Hematological responses of the Neotropical teleost matrinxa (Brycon cephalus) to environmental nitrite. Comparative Biochemistry and Physiology C 139 (1-3): 135-139.
Brauner, C. J., Matey, V., Wilson, J. M., Bernier, N. J. und Val, A. L. (2004). Transition in organ function during the evolution of air-breathing; insights from Arapaima gigas, an obligate air-breathing teleost from the Amazon. Journal of Experimental Biology 207 (9): 1433-1438.
Cazenave, J., Wunderlin, D. A., Hued, A. C. und Bistoni, M. D. (2005). Haematological parameters in a neotropical fish, Corydoras paleatus (Jenyns, 1842) (Pisces, Callichthy-idae), captured from pristine and polluted water. Hydrobiologia 537 25-33.
Chippari-Gomes, A. R., Gomes, L. C., Lopes, N. P., Val, A. L. und Almeida-Val, V. (2005). Metabolic adjustments in two Amazonian cichlids exposed to hypoxia and anoxia. Comparative Biochemistry and Physiology B 141 (3): 347-355.
Clarke, A. und Johnston, N. M. (1999). Scaling of metabolic rate with body mass and temperature in teleost fish. Journal of Animal Ecology 68 (5): 893-905.
Duque, A. B., Taphorn, D. C. und Winemiller, K. O. (1998). Ecology of the coporo, Prochilodus mariae (Characiformes, Prochilodontidae), and status of annual migrations in western Venezuela. Environmental Biology of Fishes 53 (1): 33-46.
Fernandes, M. N., Perna, S. A. und Moron, S. E. (1998). Chloride cell apical surface changes in gill epithelia of the armoured catfish Hypostomus plecostomus during exposure to distilled water. Journal of Fish Biology 52 (4): 844-849.
Fernandes, M. N. und Perna-Martins, S. A. (2001). Epithelial gill cells in the armored catfish Hypostomus cf. plecostomus (Loricariidae). Revista Brasileira de Biologia 61 (1): 69-78.
Fernandes, M. N. und Perna-Martins, S. A. (2002). Chloride cell responses to long-term exposure to distilled and hard water in the gill of the armored catfish, Hypostomus tietensis (Loricariidae). Acta Zoologica 83 (4): 321-328.
Galacatos, K., Barriga-Salazar, R. und Stewart, D. J. (2004). Seasonal and habitat influences on fish communities within the lower Yasuni River basin of the Ecuadorian Amazon. Environmental Biology of Fishes 71 (1): 33-51.
Goulding, M., Barthem, R. und Ferreira, E. (2003). The Smithsonian Atlas of the Amazon. Smithsonian Books, Washington and London; 253 Seiten.
Goulding, M., Smith, N. J. H. und Mahar, D., J. (1995). Floods of Fortune. Columbia University Press, NEW YORK; 193 Seiten.
Graham, J. (1997) Air-Breathing Fishes – Evolution, Diversity, and Adaptation, Ausg. 1, Academic Press; 299 Seiten.
Hetz, S. K. (2005). Schwarzwasser – aus der Sicht der Fische. Die Aquarien und Terrarien Zeitschrift (DATZ) 58 (9): 24-29.
Hetz, S. K. (2006). Amazonien, die Fische und der Sauerstoff. In Sonderheft Amazonas 2, Seite 6 bis 13. Ulmer Verlag, Stuttgart.
Hoppeler, H. und Weibel, E. R. (1998). Limits for oxygen and substrate transport in mammals. Journal of Experimental Biology 201 (8): 1051-1064.
Irion, G., Junk, W. J. und de Mello, J. A. S. N. (1997). The Large Central Amazonian River Floodplains Near Manaus: Geological, Climatological, Hydrological and Geomorphological Aspects. In The Central Amazon Floodplain – Ecology of a Pulsing system, vol. 126 (Hrsg. W. J. Junk), Seite(n) 23-46. SPRINGER VERLAG, BERLIN.
Jepsen, D. B., Winemiller, K. O. und Taphorn, D. C. (1997). Temporal patterns of resource partitioning among Cichla species in a Venezuelan blackwater river. Journal of Fish Biology 51 (6): 1085-1108.
Junk, W. J. (1997). General Aspects of Floodplain Ecology. In The Central Amazon Floodplain – Ecology of a Pulsing system, vol. 126 (Hrsg. W. J. Junk), Seite(n) 3-20. SPRINGER VERLAG, BERLIN.
Kokoscha, M. (2005). Kiemenveränderungen bei Sauerstoffmangel. Amazonas 2 (1): 12-13.
Mattias, A. T., Rantin, F. T. und Fernandes, M. N. (1998). Gill respiratory parameters during progressive hypoxia in the facultative air-breathing fish, Hypostomus regani (Loricariidae). Comparative Biochemistry and Physiology A 120 (2): 311-315.
Mieske, P. und Hetz, S. K. (2020): Einfluss von Haltungsfehlern auf den Sauerstoffhaushalt in Standardaquarien. Tierärztl. Prax. Ausg. K. 48 (02): 89–98.
Moron, S. E., Oba, E. T., De Andrade, C. A. und Fernandes, M. N. (2003). Chloride cell responses to ion challenge in two tropical freshwater fish, the erythrinids Hoplias malabaricus and Hoplerythrinus unitaeniatus. Journal of Experimental Zoology A 298 (2): 93-104.
Muusze, B., Marcon, J., van den Thillart, G. und Almeida-Val, V. (1998). Hypoxia tolerance of Amazon fish: Respirometry and energy metabolism of the cichlid Astronotus ocellatus. Comparative Biochemistry and Physiology A 120 (1): 151-156.
Oliveira, R. D., Lopes, J. M., Sanches, J. R., Kalinin, A. L., Glass, M. L. und Rantin, F. T. (2004). Cardiorespiratory responses of the facultative air-breathing fish jeju, Hoplerythrinus unitaeniatus (Teleostei, Erythrinidae) exposed to graded ambient hypoxia. Comparative Biochemistry and Physiology A 139 (4): 479-485.
Podkowa, D. und Goniakowska-Witalinska, L. (2002). Adaptations to the air breathing in the posterior intestine of the catfish (Corydoras aeneus, Callichthyidae). A histological and ultrastructural study. Folia Biologica-Krakow 50 (1-2): 69-82.
Podkowa, D. und Goniakowska-Witalinska, L. (2003). Morphology of the air-breathing stomach of the catfish Hypostomus plecostomus. Journal of Morphology 257 (2): 147-163.
Robertson, L. M., Val, A. L., Almeida-Val, V. F. und Wood, C. M. (2015). Ionoregulatory Aspects of the Osmorespiratory Compromise during Acute Environmental Hypoxia in 12 Tropical and Temperate Teleosts. Physiological and Biochemical Zoology 88 (4): 357 – 370.
Sakuragui, M. M., Sanches, J. R. und Fernandes, M. N. (2003). Gill chloride cell proliferation and respiratory responses to hypoxia of the neotropical erythrinid fish Hoplias malabaricus. Journal of Comparative Physiology B 173 (4): 309-317.
Salati, E. und Marques, J. (1984). Climatology of the Amazon region. In The Amazon – Limnology and landscape ecology of a mighty tropical river and its basin, vol. 56 (Hrsg. H. Sioli), Seite(n) 85-126. KLUWER ACADEMIC PUBLISHERS, DORDRECHT BOSTON LANCASTER.
Sato, Y., Fenerich-Verani, N., Verani, J. R., Vieira, L. J. S. und Godinho, H. P. (2000). Induced reproductive responses of the neotropical Anostomid fish Leporinus elon-gatus Val. under captive breeding. Aquaculture Research 31 (2): 189-193.
Severi, W., Rantin, F. T. und Fernandes, M. N. (1997). Respiratory gill surface of the serrasalmid fish, Piaractus mesopotamicus. Journal of Fish Biology 50 (1): 127-136.
Silvano, R. A., do Amaral, B. D. und Oyakawa, O. T. (2000). Spatial and temporal patterns of diversity and distribution of the Upper Jurua River fish community (Brazilian Amazon). Environmental Biology of Fishes 57 (1): 25-35.
Sioli, H. (1984). The Amazon and its main affluents: Hydrography, morphology of the river courses, and river types. In The Amazon – Limnology and landscape ecology of a mighty tropical river and its basin, vol. 56 (Hrsg. H. Sioli), Seite(n) 127-165. KLUWER ACADEMIC PUBLISHERS, DORDRECHT BOSTON LANCASTER.
Sloman, K. A., Wood, C. M., Scott, G. R., Wood, S., Kajimura, M., Johannsson, O. E., Almeida-Val, V. M. F. und Val, A. L. (2006). Tribute to R.G. Boutilier: The effect of size on the physiological and behavioural responses of oscar, Astronotus ocellatus, to hypoxia. Journal of Experimental Biology 209 (7): 1197 – 1205.
Sundin, L., Reid, S. G., Rantin, F. T. und Milsom, W. K. (2000). Branchial receptors and cardiorespiratory reflexes in a neotropical fish, the tambaqui (Colossoma macropomum). Journal of Experimental Biology 203 (7): 1225-1239.
Weiss, R. F. (1970). Solubility of Nitrogen, Oxygen and Argon in Water and Sea-water. Deep Sea Reasearch 17 (4): 721-735.
Winemiller, K. O. und Jepsen, D. B. (1998). Effects of seasonality and fish movement on tropical river food webs. Journal of Fish Biology 53 267-296.
