Nitrit
Entstehung und Wirkung von Nitrit im Wasser
Stickstoff, das chemische Symbol dafür ist \(N\) (für Nitrogenium), ist in unserer Atemluft zu ungefähr vier Fünfteln (oder etwas genauer: ca. 78%) in Gasform als \(N_{2}\) enthalten. Gasförmiger Stickstoff ist jedoch inert (reaktionsträge), geht also – zumindest “freiwillig” oder bei “normalen Umgebungsbedingungen” – so gut wie keine oder nur sehr wenige chemische Verbindungen ein. Stickstoff schadet uns deshalb auch in der Atemluft nicht. Anders sieht es bei einigen Stickstoffverbindungen in der Luft und besonders im Wasser aus: Im Wasser kommt Stickstoff in vielen organischen und anorganischen Verbindungen vor, die auf verschiedene Weise ins Wasser gelangen können. So zum Beispiel, wenn Fische stickstoffhaltige Bestandteile aus dem Abbau des Futters ausscheiden oder wenn sich Proteine (Eiweiße), die aufgrund ihrer molekularen Struktur der an ihrem Aufbau beteiligten Aminosäuren Stickstoff in größeren Mengen enthalten, im Aquarium durch Stoffwechselprozesse zersetzen. So findet sich besonders viel Stickstoff in den Proteinen, die im Futter enthalten sind. Einen genauen Anteil an Stickstoff kann man jedoch ohne eine präzise Analyse des Futters nicht angeben. Die Fische nehmen das Futter auf und verdauen es. Mit einem Teil bauen sie aus den im Futter enthaltenen Proteinen bzw. den Aminosäuren ihre Gewebe auf, bestehen also selbst zu einem gewissen Anteil aus Proteinen (und damit aus Stickstoff). Den anderen Teil verstoffwechseln sie für die Energiegewinnung wobei Abbauprodukte entstehen.
Auf eines der für Fische potenziell toxischen Abbauprodukte der Proteine, das Nitrit, chemisch \(NO_{2}^-\), gehe ich im folgenden Text etwas genauer ein. Dessen in Aquarianerkreisen vielzitierte Toxizität hängt von verschiedenen Parametern ab. Sowohl von der Physiologie der Fische als auch von den anderen »Wasserparametern«. Einmal in den Fisch gelangt (auf welche Weise dies geschieht, werde ich weiter unten etas detaillierter aufzeigen), zeigt Nitrit aufgrund seiner chemischen Eigenschaften verschiedene physiologische Reaktionen, von denen die Beeinträchtigung der Sauerstoffaufnahme aus dem Wasser ins Blut und von dort zu den Geweben eine der wichtigsten ist.
Wie Nitrit entsteht, wie komplex die Aufnahme und Wirkung von Nitrit im Fischorganismus sein kann und wie man eine Vergiftung mit Nitrit verhindern kann, welche Rolle die Filterung in einem Aquarium spielt und wie lange es dauert, eine bestimmte Menge an Nitrit abzubauen, sind wichtiges Wissen, um haltungsbedingten Schäden an den im Aquarium oder im Gartenteich gehaltenen Fischen vorzubeugen. Die mit der Entstehung und dem Abbau von Nitrit direkt und indirekt verbundenen Wasserparameter sind somit wichtige Messgrößen im Aquarium.
Nitrit?
Nitrit wird beim Menschen direkt mit der Nahrung aufgenommen, entweder direkt als \(NO_{2}^-\) oder indirekt als Reduktionsprodukt von Nitrat (\(NO_{3}^-\)) aus Trinkwasser und nitrathaltiger Nahrung. Das aufgenommene Nitrit steht mit Stickstoffmonoxid (\(NO\)), einem wichtigen Signalmolekül für die Steuerung der Durchblutung, in Verbindung. Aus diesem \(NO\) kann Nitrit unter bestimmten Bedingungen im Organismus entstehen (Jensen 2009). Weite Teile der älteren Bevölkerung werden Nitrit vor allem als Pökelsalz bei haltbar gemachten Fleischprodukten oder als Grund für die in früheren Jahren verbreitete Einschränkung der Sauerstoffaufnahme bei Kleinkindern („Blausucht“) kennen.
Normalerweise findet sich Nitrit im Blutplasma von Säugern nur in sehr geringen Konzentrationen. Diese liegen zwischen 0.1 und 0.6 (max. 1) µmol/l (Kleinbongard et al. 2003). Ich werde im folgenden Artikel vor allem molare Konzentrationen (mol/l oder µmol/l) angeben auch wenn diese Angabe ggf. für Aquarianer ungewohnt ist. Die Konzentration von Nitrit wird in der Aquaristik typischerweise in der Einheit mg/l (Milligramm Nitrit pro Liter Wasser) angegeben. Bisweilen findet man auch Konzentrationsangaben bezogen auf den Stickstoff in der Verbindung (Milligramm N pro Liter Wasser). In der Aquaristik und Aquakultur strebt man, unterstützt durch die Messung mit einfach zu handhabende standardisierten Farbtests (Farbreaktion mit steigender Konzentration: von gelb über orange bis rot), immer möglichst niedrige Nitrit-Konzentrationen an (Geisler 1964). Diese sollten im Haltungswasser maximal im Bereich von 0.2 bis 0.5 mg/l liegen. Dies entspräche einer molaren Konzentration zwischen ungefähr 4 und 10 µmol/l. Die Molmasse von Nitrit beträgt 46.01 g/mol, 46 mg wären also 1 mmol, 46 µg, also ca. 0.05 mg (siehe unten) wären demnach 1 µmol. Diese niedrigen Konzentrationen sind in der Fischhaltung besonders vor dem Hintergrund der Aufnahmemechanismen von Nitrit aus dem Wasser wichtig, die alle in der Einheit µmol/l angegeben werden. Damit man diese beiden Welten in Verbindung bringt, habe ich die Einheit µmol/l gewählt. Unbelastete natürliche Gewässer zeigen typischerweise Nitrit-Konzentrationen unter 1 µmol/l (Jensen 2003) bzw. unter 0.05 mg/l, der typischen Nachweisgrenze käuflicher Nitrittests.

Genauigkeit von Nitrittests?
Käufliche Nitrit-Tests werden meines Wissens nach einem standardisierten Verfahren hergestellt. Beim Test werden zwei Flüssigkeiten, die Reagenzien mit einem definierten Volumen von zu testendem Wasser zusammengebracht. Je nach Konzentration von Nitrit färbt sich die so behandelte Probe von hellem Gelb über Orange zu dunklem Rot. Fehler treten vor allem bei der Abmessung des zu testenden Wasservolumens und der Zugabe der Regenzien auf.
Bei der Abmessung des Probenvolumens muss der Meniskus des Probenwassers genau beachtet werden. Bei der Zugabe der Reagenzien muss genau darauf geachtet werden, dass die Reagenzienbehälter exakt so gehalten werden, wie in der Anleitung gefordert. Der Hintergrund ist, dass das Reagens nur dann in einer, der gewünschten Menge bzw. Anzahl der Tropfen entsprechenden exakten Dosierung zugegeben wird. Die Tropfengröße entspricht dabei ungefähr 50 µl und sogt dafür, dass Reagesn und Probe im richtigen Verhältnis zugegeben werden. Ein paar Prozente Abweichung machen in den meisten Fällen nichts aus und sind unvermeidlich. Näheres zu Tropfengröße siehe hier.
Woher kommt das Nitrit bei Fischen?
Zurück zum Nitrit: Bei Süßwasserfischen wurden im Blutplasma jedoch sehr viel höhere Konzentrationen (teilweise kurzfristig bis zu 10 µmol/l, siehe Jensen 2009) als bei Säugetieren festgestellt, die auf eine weitere, für wasserlebende Tiere wichtige Quelle hinweist: Das Umgebungswasser! Nitritkonzentration können in mit Stickstoff belasten Gewässern – dazu können unter Umständen auch schlecht gepflegt Aquarien gehören – in unterschiedlichen, teilweise sogar extrem hohen Konzentration bis zu 1000 µmol/l auftreten (Kroupova et al. 2005). Aber auch bei relativ niedrigen Konzentrationen im Wasser wurden erhöhte Konzentration im Blutplasma von Fischen gefunden. Wie das? Normalerweise gelangen Stoffe, wenn sie passiv durch Diffusion aufgenommen werden, immer aufgrund eines Konzentrationsgradienten in die Organe. Also immer von der hohen hin zur niedrigen Konzentration. Dazu gibt es verschiedene Erklärungsmöglichkeiten.
Meinungsvielfalt
Die Art und Weise, wie Nitrit durch den Fisch aufgenommen wird, wurde lange Zeit unterschiedlich diskutiert. Messungen zeigten, dass die Nitritkonzentration im Blut und in verschiedenen Geweben erheblich, teilweise um den Faktor 60 über der Konzentration des Umgebungswassers liegen kann (Margiocco et al. 1983). In Bereich der physiologischen Biologie wurde deshalb bereits in den späten 70er Jahren des letzten Jahrhunderts die Vermutung geäußert, dass die Nitritaufnahme aktiv über die Kiemen erfolgt. Im Bereich der Aquakultur wurde hingegen lange die Ansicht vertreten, dass nicht das Nitrit- Ion, \(NO_{2}^-\), sondern die undissoziierte salpetrige Säure, \(HNO_{2}\), aufgenommen wurde. Dies wurde mit der leichteren diffusiven Aufnahme ungeladener Teilchen begründet.
Passive oder aktive Aufnahme?
Beide Hypothesen hatten zunächst ihre Berechtigung. Obwohl die Konzentration an undissoziierter salpetriger Säure in Wasser mit einem pH zwischen 6 und 8 sehr niedrig ist (der pK salpetriger Säure liegt bei ca. 3.3) und selbst kritische Nitritkonzentrationen nur im µmolaren Bereich liegen, hätte salpetrige Säure über einen Ionenfallenmechanismus (ion trapping) aufgenommen werden können (Lewis, Jr. und Morris 1986). Dabei würde im Blut in den Kiemen die salpetrige Säure zu Nitrit dissoziieren und dadurch weiterhin salpetrige Säure aufgenommen werden, bis sich ein Gleichgewicht eingestellt hätte und die Nitritkonzentration konstant bliebe.
Als Ionenfallenmechanismus bezeichnet man die Tatsache, dass ungeladene Teilchen, die bei bestimmten chemischen Umgebungen in den geladenen Zustand übergehen können, im ungeladenen Zustand eine Zellmembran relativ leicht passieren können und dann – im ionisierten oder geladenen Zustand – im Zellinneren gefangen sind. Klassiker für die Demonstration des Ionenfallenmechanismus sind z.B. pH-Farbstoffe, wie Neutralrot, die sich in Zellen anreichern und diese färben.
Grundsätzlich wäre das also ein Erklärung, aber: Dieses Gleichgewicht und die maximale Konzentration an Nitrit im Blut würde vom pH des Umgebungswassers abhängen: eine pH-Differenz von 0.6 (im Blut pH 8 und im Umgebungswasser pH 7.4) würde z.B. eine Anreicherung um den Faktor 4 bedingen, eine pH-Differenz von 0.3 den Faktor 2. Außerdem sollte die Zunahme der Nitritkonzentration im Blut mit steigender Konzentration immer langsamer erfolgen, je näher sie sich der Sättigung näherte. Beides konnte jedoch im Experiment nicht beobachtet werden. Bei geringen pH-Unterschieden traten Anreicherung bis zum 60-fachen der Umgebungskonzentration auf. Die Zunahme der Konzentration erfolgte zudem linear mit zunehmender Expositionsdauer und flachte nicht ab.
Aus diesem Grund wird in der Wissenschaft derzeit die Erklärung allgemien akzeptiert, dass Nitrit aktiv aus dem Umgebuingswasser aufgenommen wird. Wie das funktioniert, lesen Sie weiter hinten. Im folgenden Abschnitt geht es zunächst darum, wie man sich auf eine erhöhte Nitritkonzentration im Aquarium vorbereiten kann. Die Vorstufen des Nitrits spielen hier natürlich eine wichtige Rolle.
Vorstufen: Bevor Stickstoff zu Nitrit wird!
Hier werde ich etwas weiter ausholen müssen. Wie oben schon erwähnt, sind die Aminosäuren im Futter die hauptsächlichen Quellen von Stickstoff im Wasser. Aminosäuren bestehen aus einer oder mehreren Amino- und einer Säuregruppe. Die Aminogruppe (\(-NH_{2}\)) trägt in den meisten Aminosäuren den wichtigsten Anteil an Stickstoff, manche Aminosäuren (Arginin, Asparagin, Glutamin, Histidin, …) beinhalten in ihrer Struktur weitere Stickstoffanteile. Die Aminogruppe, eine der wichtigsten Quellen des Nitrit, kommt auf verschiedene Weise ins Aquarienwasser.
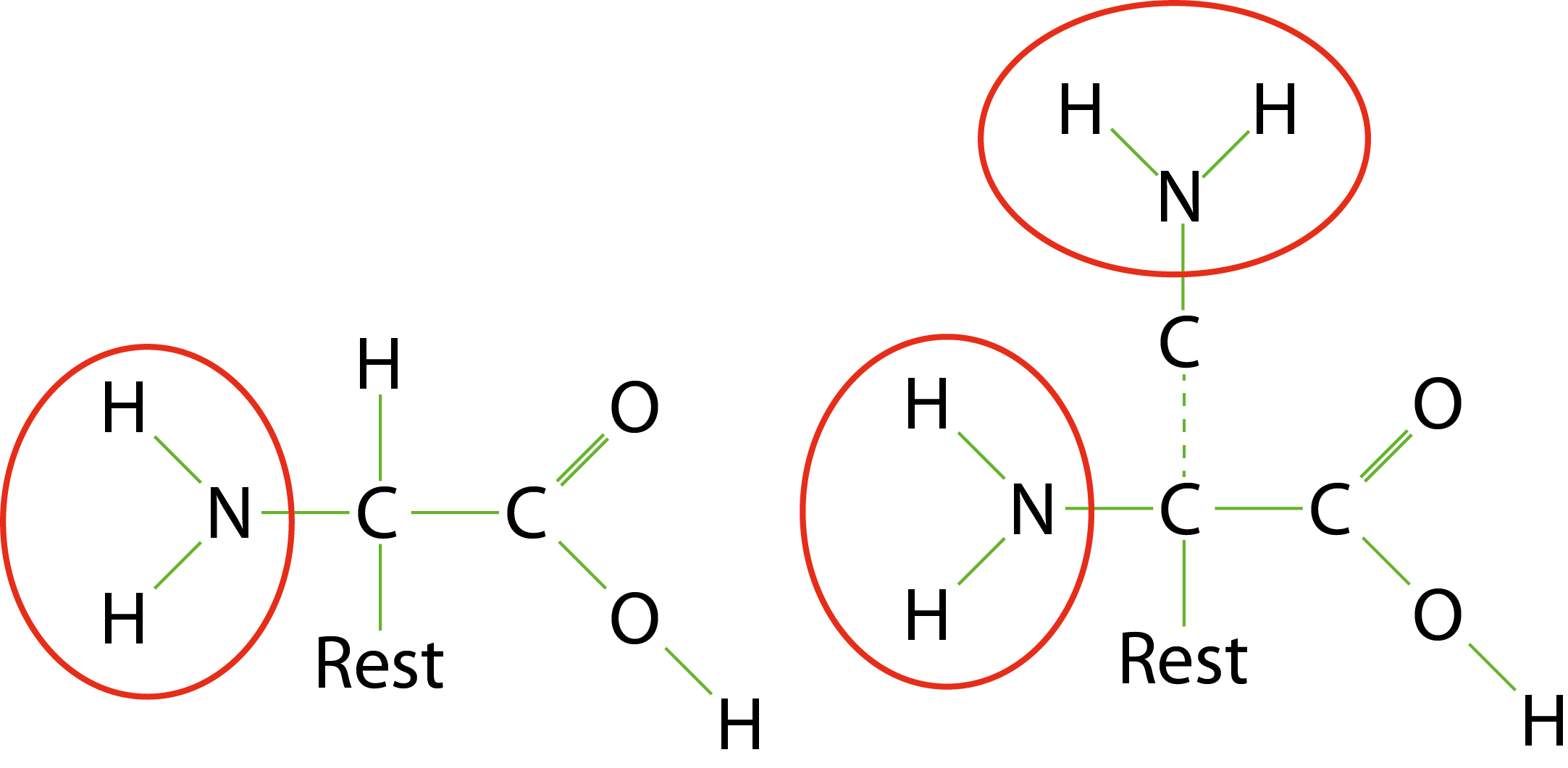
So zum Beispiel, wenn Fische stickstoffhaltige Bestandteile des Futters ausscheiden oder sich Proteine zersetzen. So findet sich Stickstoff sowohl in den Proteinen des Fischfutters als auch in den Proteinen abgestorbener Organismen. Fische nehmen das Futter auf, verdauen es, wobei die Aminogruppe abgespaltet wird, und scheiden einen Teil des Stickstoffs (der aus den Aminosäuren des Futters stammt) direkt als Endprodukt der Verdauung in Form von Ammonium/Ammoniak über die Kiemen ab. Die folgende Grafik zeigt die schematischen Zusammenhänge.
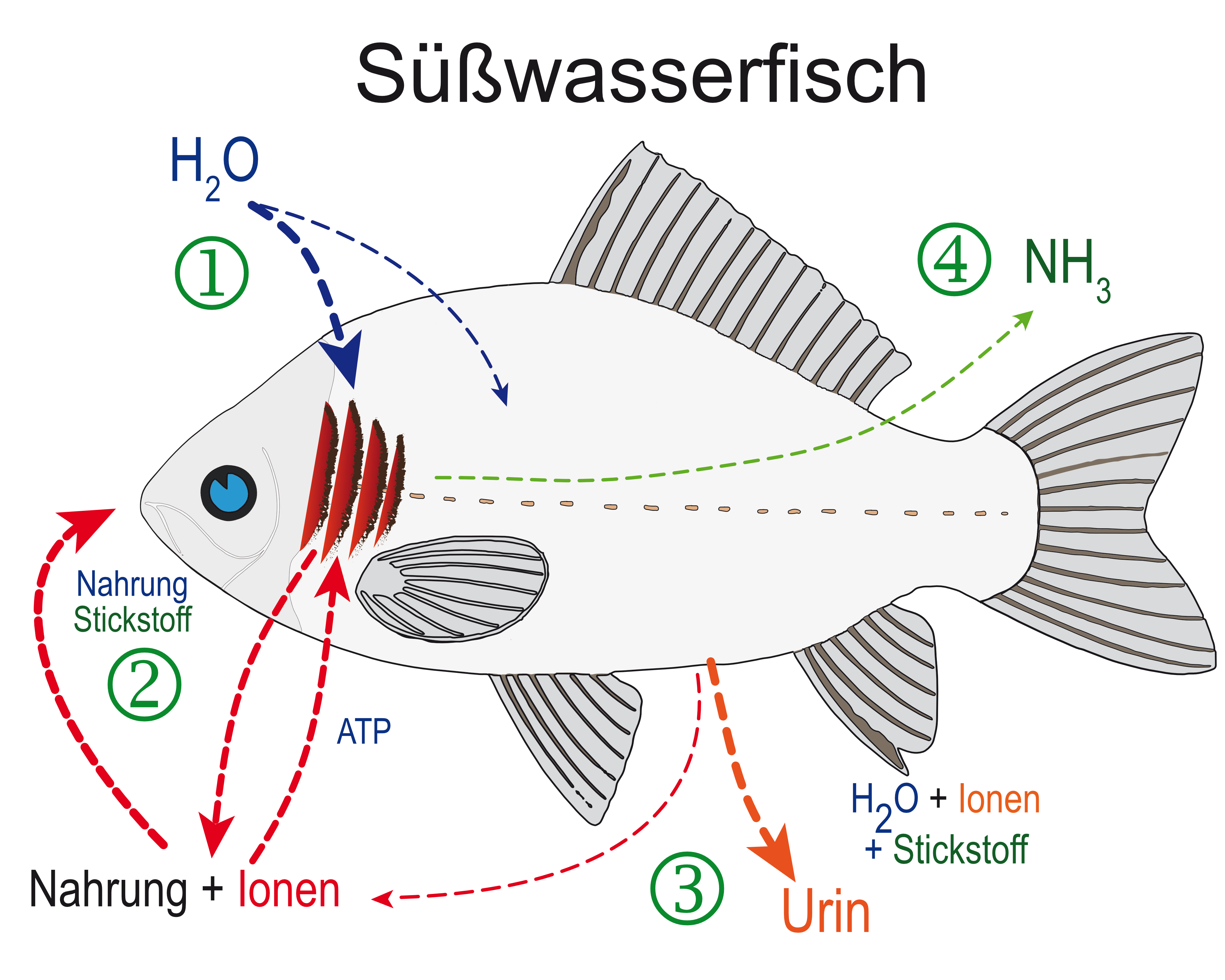
Ammoniak als Nitritvorstufe
Eigentlich geht es in diesem Artikel um Nitrit, es lohnt aber, schon mit der Vorstufe des Nitrits beim Stickstoffabbau, dem Ammonium/Ammoniak (\(NH_{4}^+\) / \(NH_{3}\)) und dessen Bedeutung im Stickstoffhaushalt eines Fisches zu beginnen. Dieser Stickstoff landet nach dem Passieren der Kiemen als Ammonium/Ammoniak (je nach pH) im Wasser! In den letzten Jahren hat man die Vorgänge bei der Abgabe von Stickstoff sehr genau untersucht und festgestellt, dass Ammonium/Ammoniak entlang einem Konzentrationsgefälle und auch durch in bestimmten Zellen der Kiemen lokalisierte Transportproteine begünstigt abgegeben werden kann. Der pH spielt hier eine wichtige Rolle, auf die wir deshalb weiter unten auch noch detaillierter eingehen werden.
Dabei ist es nicht so, dass nur ausschließlich Ammonium/Ammoniak über die Kiemen abgegeben wird: Auch Harnstoff – das hauptsächliche Endprodukt des Stickstoffstoffwechsels bei Säugetieren, wie uns Menschen – wird in geringen Mengen von Fischen abgegeben. Der Anteil von Harnstoff kann von Fischart zu Fischart und je nach Situation schwanken, oft ist er nur sehr gering, kann aber auch bei einigen Fischen unter gewissen Bedingungen das hauptsächliche Endprodukt werden. Harnstoff ist weit weniger giftig als Ammoniak, aber mit dem Harnstoff, einem relativ energiereichen Produkt, verschwenden die Fische auch unnötig Energie. Harnstoff wird deshalb nur wenn nötig abgegeben.
Vor- und Nachteile von Ammoniak
Ammoniak hat Vor- und Nachteile. Ammoniak ist zwar extrem giftig, andererseits aber auch außerordentlich gut in Wasser löslich. Wie gut, konnte ich in meinem Studium erfahren, als in der Anorganik-Vorlesung das Prinzip des Ammoniak-Springbrunnens vorgestellt wurde. Da sich Ammoniak in Wasser so begierig löst (bei Raumtemperatur ca. 700 Liter in einem Liter Wasser), wird durch einen Unterdruck, der durch die Lösung des Ammoniaks entsteht, so lange Wasser in eine abgeschlossene Ammoniakatmosphäre angesogen, bis alles Ammoniak im Wasser gelöst und der Raum vollständig mit Wasser gefüllt ist. Zum Vergleich: Kohlendioxid und Sauerstoff sind sehr viel schlechter löslich. Die Löslichkeit (in mmol/l kPa; also die Anzahl der Moleküle, die bei einem gewissen definierten Druck in einem bestimmten Volumen an Lösungsmittel gelöst werden) für Sauerstoff in Wasser bei 25°C beträgt ungefähr 0.013 mmol/l kPa, für Kohlendioxid ca. 0.4 mmol/l kPa, also 30 mal mehr. Für Ammoniak beträgt die Löslichkeit jedoch ~120 mmol/l kPa, also ca. 300 mal mehr als für Kohlendioxid welches selbst schon sehr gut löslich ist, wie wir alle aus den Erfahrungen mit “spritzigen” Mineralwasserflaschen wissen!
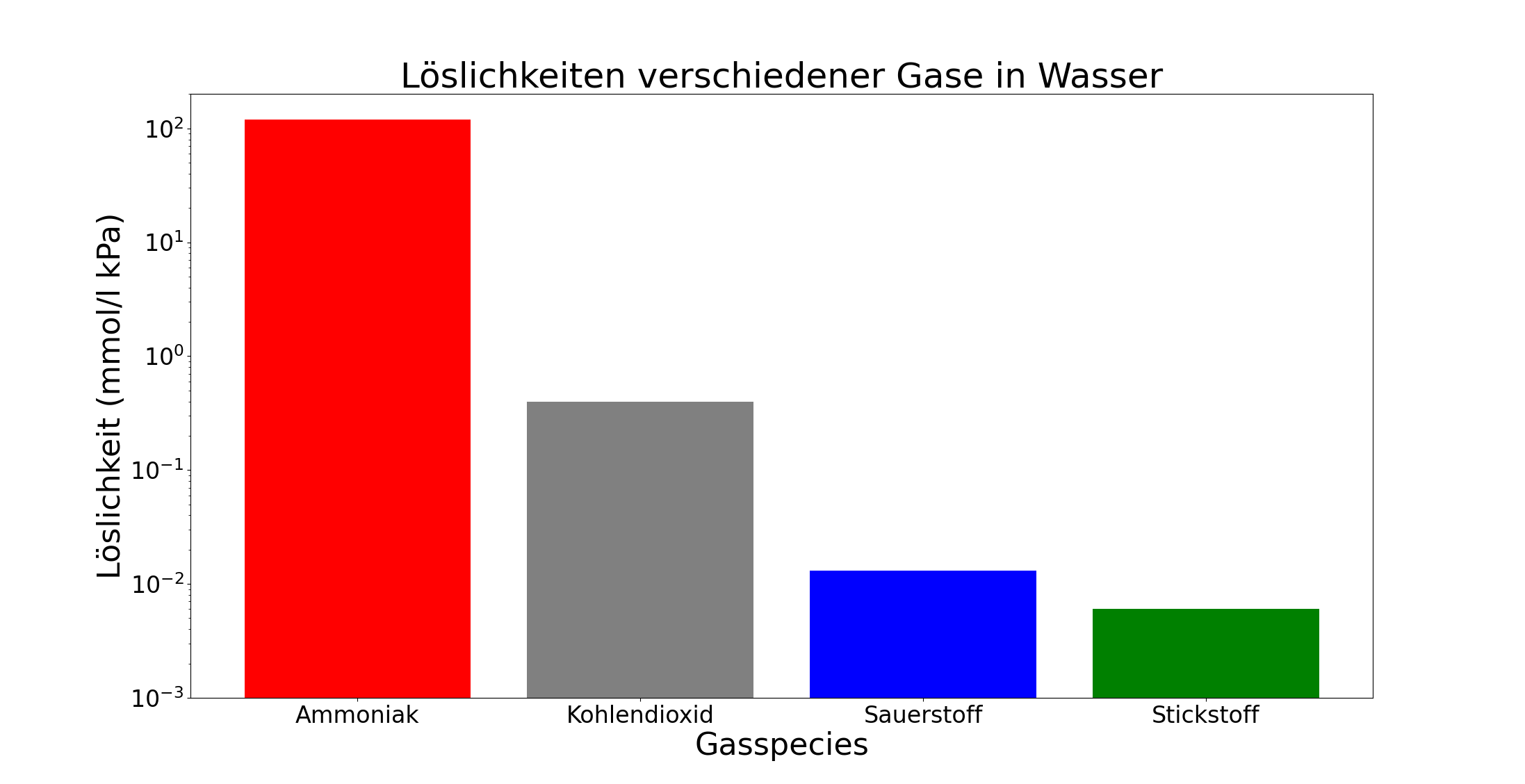
Also ist Ammoniak für Fische in einem großen Gewässer offenbar kein Problem, weil sich Ammoniak begierig im Wasser löst. Durch die sehr hohe Löslichkeit bleibt der Partialdruck von Ammoniak, der die Diffusion über das Kiemenepithel ins Wasser bedingt, selbst bei sehr hohen Konzentrationen sehr gering, was für die Diffusion, die durch Partialdruckunterschiede angetreiben wird, sehr wichtig ist. Die Konzentration von Ammoniak berechnet sich aus dessen Löslichkeit \(\alpha\) und Partialdruck \(P_{NH_{3}}\).
\[ [NH_{3}] = \alpha P_{NH_{3}}\]
umgestellt nach
\[ P_{NH_{3}} = [NH_{3}] / \alpha\]
Dieser Zusammenhang wird weiter unten noch wichtig werden. Auch wenn die Konzentration von Ammoniak stark ansteigt, steigt der Partialdruck von Ammoniak wegen dessen großer Löslichkeit in Wasser nur geringfügig an, was es dem Fisch erleichtert, Ammoniak über die Kiemen bei nur geringen Partialdruckunterschiden effektiv abzugeben. Dazu ist das Ammoniakmolekül sehr klein und ungeladen, was seine Beweglichkeit und damit die Fähigkeit, im Wasser und im Fischkörper leicht an verschiedene Stellen zu gelangen, sehr stark erhöht. Ammonium/Ammoniak ist in Fischblut mit Konzentrationen zwischen 100 und 200 µmol/l enthalten und somit höher als bei warmblütigen Wirbeltieren. Auch wird Ammoniak aus dem Blut über die Kiemen abgegeben, während es in warmblütigen Säugern sehr viel niedriger konzentriert ist, da Stickstoff vor allem als ungiftiger Harnstoff vorliegt.
Ammoniak kann aber auch sehr »sparsam«, also ohne Energieaufwand für den Organismus (anders ist es bei dem oben erwähnten Harnstoff oder der Harnsäure) hergestellt werden. Der Organismus verliert somit bei der Abgabe von Ammoniak nur sehr wenig Energie. Deutlich energiereicher – dafür aber auch weit weniger giftig – sind, wie oben schon erwähnt, Harnstoff und Harnsäure, die beiden anderen verbreiteten Abbauprodukte des Stickstoffs bei Wirbeltieren.
Was passiert mit dem Ammoniak im Wasser?
Ammonium (\(NH_{4}^+\)) und Ammoniak (\(NH_{3}\)), die beiden Stoffe werden von gängigen aquaristischen Tropftests jeweils zusammen (als Summe der Konzentrationen) gemessen, liegen in einem von pH und Temperatur abhängigen Gleichgewicht vor, was sich so beschreiben lässt:
\[ H_{2}O + NH_{4}^+ \leftrightharpoons NH_{3} + H_{3}O^+\]
Dieser Zusammenhang kann ziemlich genau berechnet werden und ist in der folgenden Grafik dargestellt: Angegeben ist für den pK von 9.2 (der pK ist der pH, bei dem die Substanzen – Säure und Base – in gleichem molaren Verhältnis vorliegen, also die Anzahl der Moleküle gleich ist) das Verhältnis von ungiftigem Ammonium und giftigem Ammoniak in Abhängigkeit des pH.
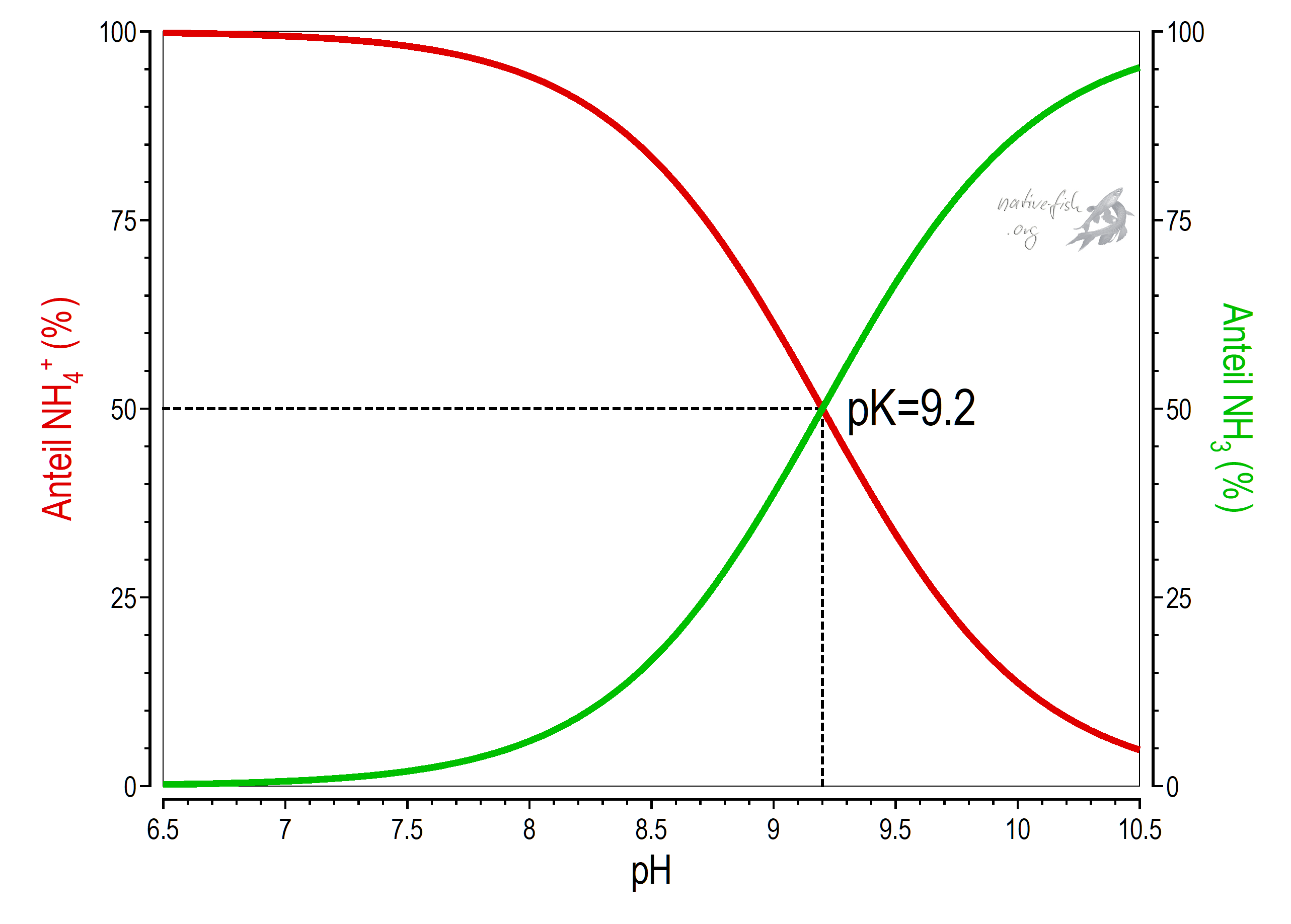
Gibt man Säure ins Wasser, verschiebt man das Gleichgewicht nach links in Richtung Ammonium, gibt man Lauge dazu (oder entfernt Säureäquivalente), verschiebt man das Reaktionsgleichgewicht nach rechts in Richtung Ammoniak. Während Ammonium nicht giftig ist – als geladenes Teilchen kann es nicht ohne weiteres durch die Zellmembranen diffundieren (es gibt deshalb Ammoniumtransportsyteme in den Membranen von Zellen in den Kiemen, vgl. auch die Aufnahme des Nitrits weiter unten) – gelangt das kleine ungeladene Ammoniakmolekül (Größe und Ladung bestimmen maßgeblich den Durchtritt von Stoffen durch Zellmembranen) vergleichsweise leicht über die Kiemen in die Zellen des Fisches oder sorgt durch eine Anreicherung außerhalb des Fisches dafür, dass aufgrund des fehlenden Konzentrationsgefälles zwischen Kiemen und Umgebungswasser kein Ammoniak über die Kiemen mehr abgegeben werden kann. Im Organismus wirkt Ammoniak deshalb ab bestimmten, meist recht niedrigen Konzentrationen als Gift. Aus der obigen Gleichung wird klar, dass, um bei einer Messung die Konzentration an giftigem Ammoniak beurteilen zu können, immer auch eine Messung des pH notwendig ist.
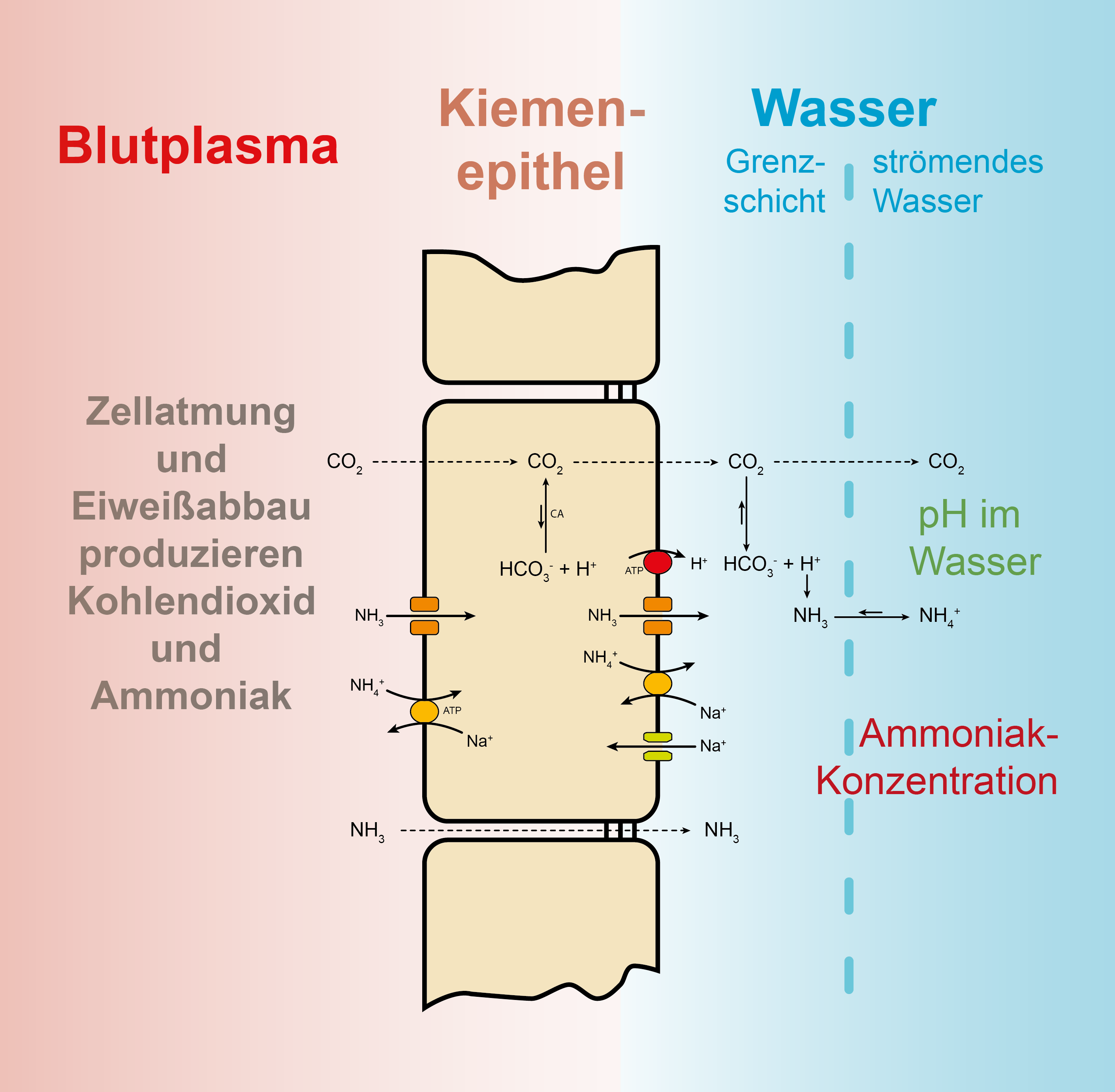
Der pH ist allerdings im Bereich der Kiemen niedriger als im Umgebungswasser, da dort die Kohlendioxidkonzentration ebenfalls (meistens) viel höher als im Umgebungswasser des Fisches ist. Der Fisch atmet ja schliesslich Kohlendioxid aus! Eine Bildung von Ammonium wird durch den vom Kohlendioxid herrührenden niedrigeren pH im Bereich der Kiemen favorisiert.
Um eine Giftigkeit des Ammoniaks aus den Messergebnissen eines käuflichen Farbtests abschätzen zu können, müssen Temperatur, pH und die Konzentration von Ammonium (\(NH_{4}^+\)) / Ammoniak (\(NH_{3}\)) gemessen werden und mit der spezifischen Empfindlichkeit der empfindlichsten Fischart in Beziehung gebracht werden. Bei niedrigen Konzentrationen besteht allerdings auch bei hohem pH keine Giftwirkung! Bei höheren Konzentrationen an Ammonium/Ammoniak lässt sich der pH, ab dem eine Giftwirkung eintritt, nur durch eine etwas komplexere Berechnung ermitteln! Das Ergebnis dieser Berechnung ist grafisch in den folgenden Grafik dargestellt.
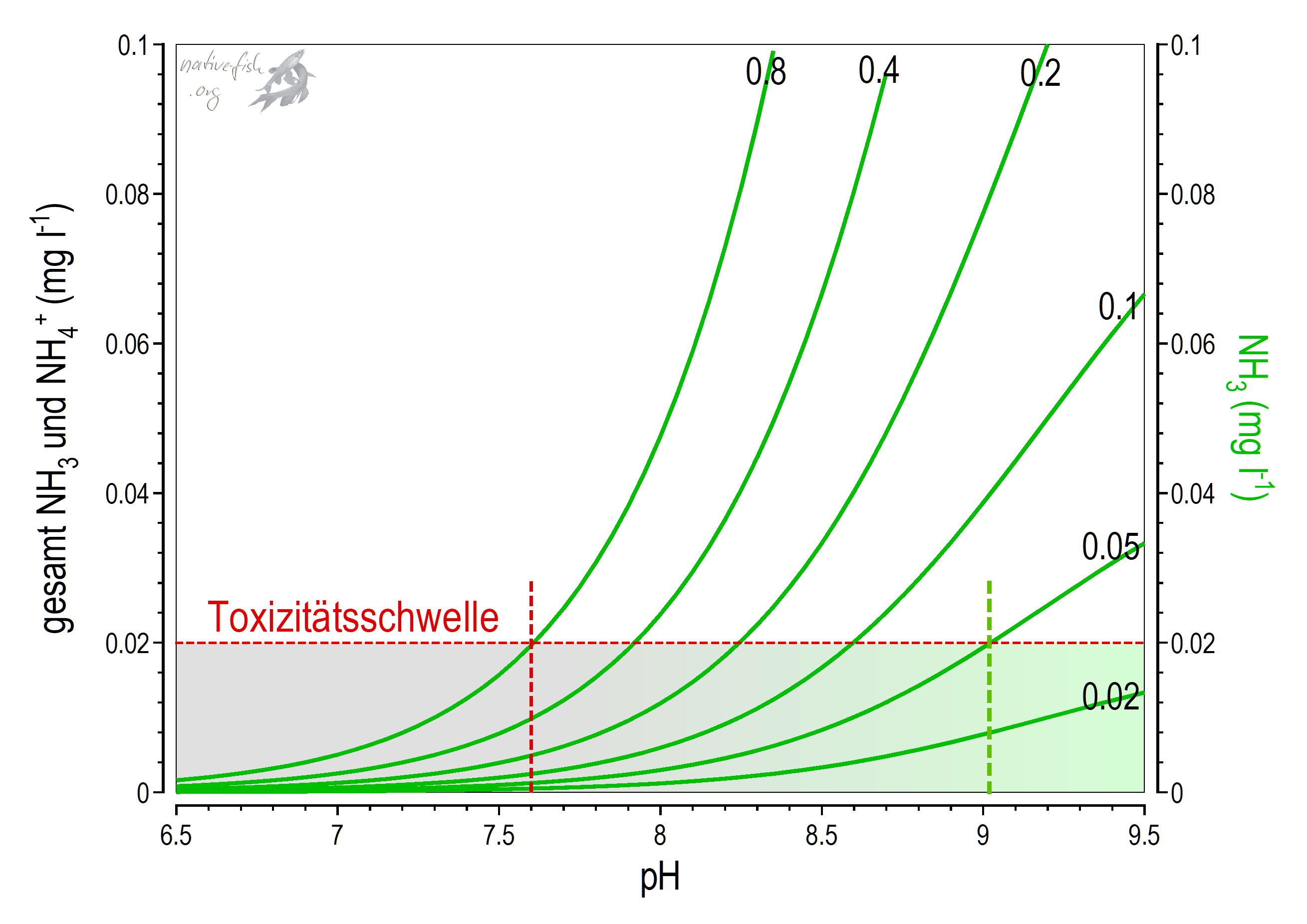
Bei niedrigen Konzentrationen von unter 0.02 mg/l (die in vielen Standardwerken der Aquaristik angegebene kritische Konzentration fü die meisten Fische für das giftige Ammoniak) besteht auch bei hohem pH keine Gefahr. Selbst bei einem extrem hohem pH zwischen 11 und 12 könnten dort maximal 0.02 mg/l Ammoniak entstehen. Mit zunehmender Konzentration von Ammonium/Ammoniak wird allerdings die Schwelle des giftigen Ammoniak schon bei niedrigerem pH erreicht, wie in der Grafik zu erkennen ist. Im dargestellten Extremfall von 0.8 mg/l Ammonium/Ammoniak wird diese Grenze schon bei pH 7.6 überschritten. Es ist also überhaupt nicht sinnvoll, ohne diese Betrachtung einen einzigen pH anzugeben, bei dem die Ammoniakkonzentration kritisch wird!
Die Schwelle der Giftwirkung einer Substanz wird in der Wissenschaft meist als diejenige Konzentration angegeben, bei denen 50% der getesteten Organismen innerhalb eine bestimmten Zeit eine bestimmte Reaktion zeigen. Das bedeutet jedoch auch, dass immer einige Individuen empfindlicher oder weniger empfindlich ragieren können. Man sollte aus diesen Gründen bei potenziell toxischen Substanzen die angegebene Toxizitätsschwelle nie ganz ausreizen. Je weiter man unter dieser Schwelle bleibt, z.B. um den Faktor 5 oder 10, desto unwahrscheinlicher ist es, dass es zu Reaktionen einzelner Organismen kommt. Bei einigen Untersuchungen wird deshalb zusätzlich zur Toxizitätsschwelle deren Reaktionsbreite (z.B. der untere und obere Wert, bei dem statistisch 5% oder 95% der getesteten Individuen reagieren) angegeben.
Das solls erstmal gewesen sein. Der nächste Abschnitt mit Literaturangaben folgt später …
Änderung am 03.02.2024: Andere Formulierung und Korrektur kleinerer Tippfehler. Danke für die Hinweise!
